Третий закон термодинамики
Понятие химического сродства.
Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует какое-то химическое сродство.
массаж эротический новосибирск1-е предположение – мерой химического сродства была скорость реакции.
2-е предположение – М. Бертло
и Х. Томсон
высказали, что мерой химического сродства является тепловой эффект
.
3-е предположение – max А (Вант-Гофф). Если max А > 0, то химическое сродство между веществами существует, и реакция протекает слева направо. Если А max< 0 →, то химического сродства между веществами нет, и реакция протекает справа налево. Если А max= 0, то реакция протекает и туда, и обратно. На основе этого создавался третий закон термодинамики; М. Бертло
и Х. Томсон
, изучая поведение термодинамических систем при низких температурах, в 1906 г. обнаружили, что при низких температурах между веществами существует так называемое химическое сродство, которое они определили как тепловой эффект, ими было установ-лено, что тепловой эффект Qv – А max в конденсированных системах при низких температурах, где А max– максимальная работа.
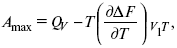
но на самом деле это не max, если исходить из уравнения Гельмгольца.
Для того, чтобы работа была max, она должна равняться тепловому эффекту A max = Qv, надо вычислить:
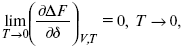
ΔF = Qv.
Аналитические выражения третьего закона термодинамики:
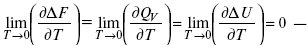
это изохорно-изотермические условия.
Если Аmax = QP , ΔG , Qp , ΔH – функции
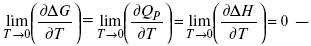
это изобарно-изотермические условия.
Тепловая теорема Нернста
(третий закон термодинамики)(рис. 16)
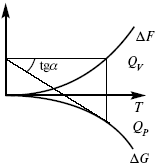
Рис. 16
Энергии (ΔU, ΔH, QV, QP, ΔF, ΔG), tgα угла наклона прямой – дает температурный коэффициент любой функции.
Для реакций, протекающих в конденсированных системах
при приближении температуры к абсолютному нулю, кривые max работы и теплового эффекта соединяются и имеют одну большую касательную, параллельную оси температур.
Следствия из третьего закона термодинамики:
1. Свойства энтропии вблизи абсолютного нуля – постулат Планка:
ΔF = ΔU – T ΔS.
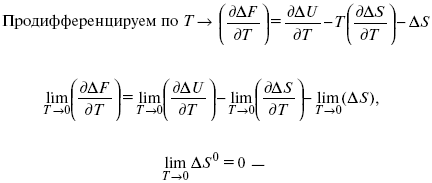
абсолютная энтропия.
2. Теплоемкость Сp, Сv
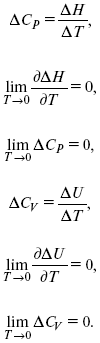
3. Коэффициент термического расширения тела и термического давления.
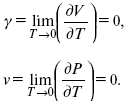
Идеальные газы не подчиняются третьему закону термодинамики, так как газ вблизи абсолютного нуля называется вырожденным.
CP – CV ≠ R вблизи абсолютного нуля – уравнение Майера не работает.
4. О невозможности достижения абсолютного нуля. Третий закон термодинамики – приближенный закон. Используется для совершенного кристалла любого вещества.
Смотрите также
Химия цвета
...
Винилхлорид
...
Гетероциклические соединения
К гетероциклическим
относятся соединения, содержащие циклы, в которых один или два (несколько)
атомов являются элементами, отличными от углерода. Гетероциклические системы
многообразны. Эле ...
