1. Понятие химического равновесия. Закон действующих масс
При протекании химической реакции через некоторое время устанавливается химическое равновесие. Существует два признака химического равновесия: кинетический, термодинамический
. В кинетическом – υпр = υобр , в термодинамическом – характеризует химическую реакцию при условиях P, t – const ( ΔG = 0); при условиях V, Т – const ( ΔF = 0).
Химический потенциал
– функция, которая характеризует состояние i -го компонента при определенных внешних условиях. 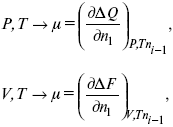
где n1 – число молей i -го компонента.
Если к бесконечно большому количеству раствора прибавить определенное количество какого-нибудь компонента, то химический потенциал системы определяется изменением изобарного потенциала при изобарных условиях или изменением изохорного потенциала при изохорных условиях.
Химический потенциал зависит от концентрации данного компонента
μi = μ0 + RTLnPi– (для идеального газа),
где Рi – парциальное давление – вклад каждого компонента в общее давление или давление, которое компонент имел бы, если бы находился в смеси.
Парциальное давление – элементарная функция (можно складывать). Пример (O2, N2, H2) – их общее давление 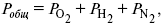
μi= μ0+ RTLnCi – (для раствора),
μ0– значение химического потенциала при стандартных условиях.
Химический потенциал характеризует способность данного компонента выходить из данной фазы путем испарения, растворения, кристаллизации и т. д. Переход этот происходит произвольно. 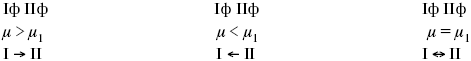
В результате химического равновесия скорость прямой реакции уменьшается, а скорость обратной реакции увеличивается.
Концентрации, которые соответствуют химическому равновесию, называются равновесными концентрациями
. Связь между равновесными концентрациями устанавливается законом действующих масс (ЗДМ)
. Этот закон в 1867 г. вывели К. М. Гульберг
и П. Вааге
.
Кинетический вывод ЗДМ 

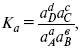
f – фугитивность – парциальное давление для реальных газов. Возникает вопрос, будут ли равняться Кp и Кс.
Кp и Кc– отличаются на RT ∑vi в сумме стехиометрических коэффициентов.
Связь между Кp и Кс 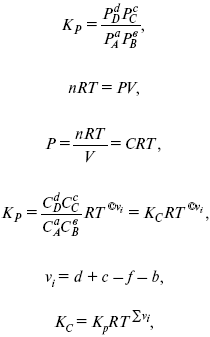
если ∑vi = 0, то Kp = Kc. ∑vi = 1 + 1 – 1 – 1 =0 – когда стехиометрический коэффициент = 1.
Смотрите также
Седьмая группа периодической системы
Из
членов данной группы водород был рассмотрен ранее. Непосредственно следующие за
ним элементы — F, Сl, Br и I — носят общее название г а л о г е н о в. К ним же
следует отнес ...
Приложение 6
Подготовка нефти, включая
газовый конденсат, в тоннах
Российская Федераци 910610930
Западная Сибирь 708316453
Тюменская область ...
