2. Уравнение изотермы химической реакции
Если реакция протекает обратимо, то ΔG = 0.
Если реакция протекает необратимо, то ΔG ≤ 0 и можно рассчитать изменение ΔG. 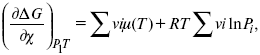
где χ – пробег реакции – величина, которая показывает, сколько молей изменилось в ходе реакции. I сп – характеризует равновесное и неравновесное состояние реакции, II сп – характеризует только неравновесные состояния.
Если
д χ = 1,
то 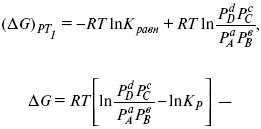
это уравнение изотермы химической реакции
. 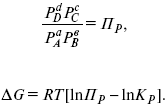
С помощью уравнения изотермы химической реакции можно судить о направлении протекания реакции.
1) Пp< Кp, ΔG < 0, слева направо;
2) Пp> Кp, ΔG > 0, справа налево;
3) Пp= Кp, ΔG = 0, химическое равновесие.
Смотрите также
Спирты
...
Вода
Вода, у тебя нет ни цвета, ни вкуса, ни запаха, тебя
невозможно описать, тобой наслаждаются, не ведая, что ты такое. Нельзя сказать,
что необходимо для жизни: ты сама жизнь. Ты исполняешь ...
Выбор реактора для проведения реакции окисления сернистого ангидрида в серный ангидрид
Задание
Обосновать выбор
реактора для окисления SO2.
Получить
максимальную степень окисления SO2, если изменяются давление, начальная температура и начальная
концентрация (Х ...
