3. Современные подходы к описанию термодинамических свойств растворов электролитов
При теоретическом подходе к концентрированным растворам электролитов предпринимались попытки уточнить классическую модель теории Дебая – Хюккеля за счет учета следующих эффектов:
1) собственного объема ионов;
2) изменения диэлектрической проницаемости вблизи ионов вследствие диэлектрического насыщения растворителя;
3) изменения макроскопической диэлектрической проницаемости в объеме раствора в зависимости от концентрации и т. д.
Общий недостаток работ этого направления состоит в том, что в каждой из них учитывают только один или два из перечисленных эффектов.
Расхождение современных статических теорий наблюдается, в основном, в ходе функций распределения на малых расстояниях. Теоретический расчет потенциала взаимодействия частиц на малых расстояниях сложен и не может быть пока проведен однозначно, так как на таких расстояниях, наряду с кулоновскими силами, играют роль квантово-механические, дисперсионные и другие силы.
Г. Кеселером
было развито специфическое взаимодействие ионов в растворах и показано, что некулоновские эффекты при сближении ионов проявляются вследствие десольватации ионов (при перекрытии сфер сольватации) и сольватации ионных пар как целого.
Термодинамические характеристики ион-молекулярных взаимодействий в растворах
Теория Дебая и Хюккеля позволила предсказать эффект выделения тепла при разбавлении растворов электролитов, вызванный тем, что при разбавлении уменьшается взаимодействие между ионами.
Характеристики
Химический потенциал 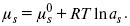
Средняя активность 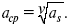
Коэффициент активности характеризует работу перенесения иона из идеального газа в реальный.
Абсолютная активность 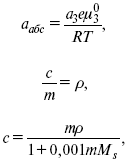
где МS– молярная масса растворенного вещества.
Смотрите также
Сложные реакции
...
Водородная связь
Помимо различных
гетерополярных и гомеополярных связей, существует еще один особый вид связи,
который в последние два десятилетия привлекает все большее внимание химиков.
Это так называемая ...
Аналитическая химия
Предмет и задачи
аналитической химии (АХ). Значение АХ в производственной и
научно-исследовательской деятельности человека. Химические и физико-химические
методы анализа. Качественный и кол ...
