2. Уравнения электрохимической кинетики, пределы их применимости
1-й закон Фарадея
устанавливает прямую пропорциональность между количеством прошедшего через систему электричества и количеством прореагировавшего вещества.
Δm = kэJt = kэq , (1)
где Δm – количество прореагировавшего вещества;
k – коэффициент пропорциональности;
q – количество электричества, равное произведению силы тока I на время t .
Если q = Jt = 1, то Δm = kэ – количество вещества, прореагировавшего в результате протекания единицы количества электричества.
kэ – электрохимический эквивалент.
2-й закон Фарадея
устанавливает связь между количеством прореагировавшего вещества при пропускании данного количества электричества и его природой.
По этому закону, при постоянном количестве прошедшего электричества массы прореагировавших веществ относятся между собой, как их химические эквиваленты А : 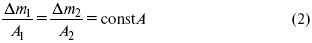
Если количество электричества равно F , числу Фарадея, то Δm 1 = Fkэ 1 = A 1, Fkэ при q = 1F , то 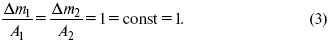
Уравнение (3) позволяет объединить оба закона Фарадея в виде одного общего закона, по которому количество электричества (1F = 96500k) всегда изменяет электрохимически массу любого вещества, независимо от его природы.
Законы Фарадея
– основные законы электролиза, согласно которых, количество вещества, выделившегося при электролизе, прямо пропорционально его химическому эквиваленту и количеству прошедшего электричества.
Уравнение Нернста
Е 0 – равновесный стандартный потенциал. 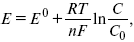
где С0 – стандартная концентрация раствора;
С – любая концентрация в нестандартных условиях, С = С0 x Е = Е 0 , т. е. в стандартных условиях С = C0 = 1 моль.
Для окислительных веществ 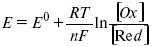
1-й закон Фика:
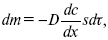
где dc/dx – градиент концентрации;
s – площадь, через которую происходит диффузия.
Δ – коэффициент диффузии cм2 x c-1, показывает число частиц, продиффундировавших за 1 с через поперечное сечение раствора площадью 1 см2, dt – время диффузии, dm – число продиффундировавших частиц. 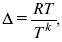
где Тк – коэффициент внутреннего трения;
D – коэффициент диффузии.
Первый закон Фика относится к процессу стационарной диффузии, сходен с закономерностями переноса тепла из электричества. 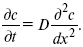
Если диффузионный поток не изменяется с течением времени, это называется стационарной диффузией
.
Диффузия
– самопроизвольно протекающий в системе процесс выравнивания концентрации молекул, ионов, частиц под влиянием теплового хаотического движения.
Основное уравнение электрохимической кинетики
ik = ia = i0,
где i 0 – ток обмена, 
(окислительно-восстановительные реакции).
При катодной поляризации на электроде через систему протекает ik преимущественно, если поляризация не слишком велика, то суммарная скорость процесса равна:
i = ik – ia,
для реакции (1) катодные и анодные токи будут равны: 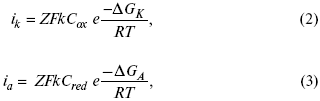
где Z – количество электронов, участвующих в реакции;
F – число Фарадея;
к – const скорости;
Сox, Cred – концентрация окислительной и восстановленной форм реагентов;
ΔGK – энергия активации катодного процесса;
ΔGA – энергия активации анодного процесса.
Энергия активации зависит от величины накладываемого потенциала, в то же самое время эта энергия распределяется между прямой и обратной реакцией в соответствии с коэффициентом переноса – а, т. е.
υ = υпр – υоб.
Коэффициент переноса α – доля энергии электрического поля в ДЭС, которая приходится на прямую и обратную реакции.
α– коэффициент переноса для катодной реакции;
(1 – α) – для анодного процесса (коэффициент переноса).
ΔGk = ZFE α, (4)
Смотрите также
Химия лантаноидов
Судя
по последним публикациям, нынче довольно трудно отметить те стороны жизни, где
бы не находили применение лантаноиды.
На
основе лантаноидов получают многие уникальные материалы, кото ...
Перечень условных сокращений, обозначений, применяемых в
проекте.
АК - азотная кислота
СК - серная кислота
НКЛ – нитрокаллоксилин
ОК - отработанная кислота
ВКУ – вихревое контактное устройство
АСУТП – автоматизированные системы
управления технологич ...
Хитин-глюкановый комплекс грибного происхождения. Состав, свойства, модификации
Биополимеры
хитин и хитозан обратили на себя внимание ученых почти 200 лет назад.
Хитин был открыт в 1811 г. (Н. Braconnot, A. Odier), а хитозан
в 1859 году (С. Rouget), хотя свое нынешнее ...
