4. Влияние природы растворителя на скорость электрохимических реакций
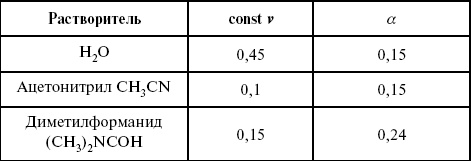
Замена одного растворителя на другой скажется на каждой из стадий электрохимического процесса. В первую очередь это отразится на процессах сольватации, ассоциации и комплексообразования в растворах, скажется на стадии диффузии, на скорости процесса разряда ионизации. Изменения в объеме раствора электролита, связанные с процессами сольватации, ассоциации, скажутся на скорости доставки вещества к поверхности электрода и на скорости разряда ионизации. Влияние природы растворителя на стадии разряда ионизации проявляется изменениями константы скорости реакции, коэффициента переноса. Например, при электровосстановлении кадмия из растворов с различными растворителями были получены следующие величины для константы скорости и коэффициента переноса α – доли энергии (табл. 7).
Таблица 7
Получение величины для константы скорости и коэффициента переноса
Объяснение изменений кинетических параметров процесса состоит в следующем:
1) изменяется строение ДЭС;
2) изменяется адсорбционная способность разряжающихся частиц;
3) разряжающиеся ионы имеют различную сольватную оболочку.
Для объяснения влияния природы растворителя на скорость реакции в объеме раствора была использована теория «Абсолютных скоростей реакции». Основным моментом данной теории является введение понятия «активированный комплекс». Рассмотрим изменение ΔG (свободная энергия Гиббса) при замене одного растворителя на другой (рис. 12). 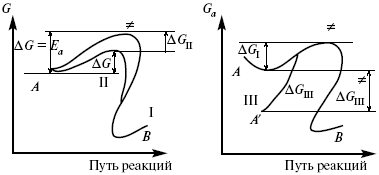
Рис. 12. Энергетические профили реакции. А – исходное энергетическое состояние для реагента, участвовавшего в реакции, В – энергетическое состояние продуктов реакции, ≠– активированный комплекс.
Для того чтобы прошла реакция в исходное состояние и перешла в состояние активированного комплекса, требуются затраты энергии – Еа . Энергетический профиль, описанный кривой I, соответствует состоянию, когда исходное вещество и активированный комплекс не сольватированы. Энергия, необходимая для превращения вещества А в вещество В для реакции: F = ΔG I≠. При замене растворителя допустим вариант (а): происходит сольватация активированного комплекса – кривая II. В этом случае наблюдается уменьшение Еа процесса на величину ΔG II≠. При сольватации исходного реагента (вариант б) – кривая III, происходит увеличение Еа процесса на величину ΔG III≠.
Смотрите также
Химия наследственности. Нуклеиновые кислоты. ДНК. РНК. Репликация ДНК и передача наследственной информации
Мы
рождаемся, взрослеем, у нас появляются дети и внуки. Мы ни одни живые существа
на этой планете, вокруг нас ежечасно, ежесекундно происходит зарождение новой
жизни. Этот процесс ...
Витамины и их значение для организма
Трудно представить, что
такое широко известное слово как «витамин» вошло в наш лексикон только в начале
XX века. Теперь известно, что в основе жизненно важных процессов обмена веществ
в орг ...
Витамины. Заболевания при избытке и недостатке витаминов в организме
Витамины — группа низкомолекулярных
органических соединений относительно простого строения и разнообразной
химической природы. Это сборная, в химическом отношении, группа органических
вещес ...
