Ферментативный катализ реакций гидролиза
Каталитическая активность карбоангидразы не понижается при замене Zn2+ на ион Со2+, в других случаях активность фермента либо падает, либо исчезает.
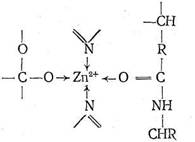
Карбоксипептидаза представляет собой фермент, вырабатываемый поджелудочной железой млекопитающих. Так же как карбоангидраза, этот фермент содержит один ион Zn2+ на одну белковую макромолекулу, молекулярная масса которой 34300. Биологическая роль карбо-ксипептидазы заключается в катализе процесса гидролиза пептидов — разрыве пептидной связи на карбоксильном конце пептидной цепи:
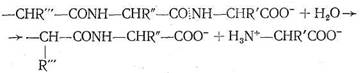
Ион Zn2+ в карбоксипептидазе, так же как в карбоангидразе, находится в полости активного центра фермента, но только два места в его координационной сфере заняты азотом имидазольных остатков гистидина. Третье место занято кислородом другой аминокислоты — глутамина. Четвертое координационное место в координационной сфере Zn2+ принадлежит молекуле воды. Таким образом, и в этом ферменте координационная сфера Zn2+ несимметрична, что, по-видимому, обусловливает напряженность структуры фермента и является обязательным условием каталитической активности комплексных соединений. Предполагают, что одной из важных стадий каталитического процесса, протекающего с участием карбоксипептидазы, является координация ионом Zn2+ атома кислорода карбонила пептидной цепи
|
|
с вытеснением Н2О, занимающей одно место в координационной сфере. Координация цинком карбонильного кислорода ослабляет связь С—N в пептидной цепи, что облегчает ее разрыв, сопровождающийся гидролизом. Гидролиз разорванной цепи приводит к ослаблению координации карбонильного кислорода пептидной цепи ионом Zn2+. Происходит вытеснение молекулой Н2О, затем вновь следует координация ионом Zn2+ карбонильного кислорода неразорванной цепи и т, д, Ферментативная активность карбоксипептидазы сохраняется, если Zn2+ заменить на ион Со2+, так же как в случае карбоангидразы. По-видимому, это связано с очень близкими величинами констант устойчивости (т. е. сходными термодинамическими, характеристиками) аналогичных комплексов Zn2+ и Со2+, а также одинаковыми размерами этих ионов. Замена Zn2+ в карбоксипептидазе на Gd2+, Hg2+, Cu2+, Pb2+ приводит к исчезновению каталитической активности фермента.
К группе ферментов, катализирующих процессы гидролиза, относятся также киназы, ускоряющие перемещение различных фрагментов биолигандов (например, ионы РО3-)от одного биополимера к другому. Все киназы содержат ионы М2+. Аминопептидазы (ионы Mg2+, Zn2+, Mn2+, Ca2+—кофермент) катализируют гидролиз пептидов, при этом каждый из большого числа ферментов, входящих в эту группу, ускоряет разрыв пептидной связи именно для данного сочетания разноименных аминокислот в пептидной цепи. Фосфатазы катализируют гидролиз сложных эфиров на основе ортофосфорной кислоты.
Смотрите также
Использование альтернативных источников энергии
Во второй половине ХХ столетия перед
человечеством восстала глобальное проблема – это загрязнение окружающей среды
продуктами сгорания органического топлива. Даже если рассматривать отдельно ...
Электрокинетические явления в дисперсных системах
Электрокинетические
явления были открыты профессором Московского университета Ф.Ф.Рейсом в 1808г.
при исследовании электролиза воды.
Явление
перемещения жидкости в пористых телах под дей ...
Аммиачная селитра
Важнейшим видом минеральных
удобрений являются азотные: аммиачная селитра, карбамид, сульфат аммония,
водные растворы аммиака и др. Азоту принадлежит исключительно важная роль в
жизнедеятел ...