7. Метод гальваностатических кривых
В этом методе анализируется зависимость Е, t при заданной i . 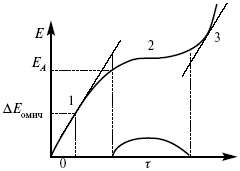
Рис. 15.1, 3 – резкое изменение потенциала, где наступает заряжение ДЭС (изменение заряда поверхности); ΔE/ Δt– угловой коэффициент наклона, по нему можно рассчитать емкость ДЭС.
Для этого необходимо кривую записывать с помощью осцилирования, так как заряжение ДЭС происходит в течение тысячных долей секунды. В обычных условиях прибора КСП-4 кривую можно зарегистрировать с точностью до 0,1 с, определяемую по угловому коэффициенту; емкость является поляризационной емкостью (псевдоемкость). Она характеризует количество адсорбированных частиц на электроде, которые вступают в электрохимическую реакцию. Потенциал начала реакции, где первая дуга переходит во вторую – Еa. Участок 2 характеризует время протекания электрохимической реакции. Из точек пересечения касательных опускаем перпендикуляр и находим отрезок, τ – переходное время процесса, i x τ = Q– количество образовавшегося продукта. Можно на основе определения переходного времени процесса при различных плотностях тока анализировать зависимость τ от i . Для замедленной стадии диффузии, лимитирующей скорость суммарного электрохимического процесса, зависимость между переходным временем и плотностью тока: 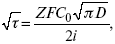
F – число Фарадея;
С 0 – объемная концентрация ионов в растворе;
D – коэффициент диффузии.
В случае замедленной диффузии 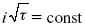
(зависит только от концентрации раствора) по угловому коэффициенту наклона прямой можно рассчитать коэффициент диффузии. 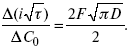
Знание зависимости переходного времени от i позволяет определить const скорости химической стадии и Кр; если электрохимическая реакция лимитируется замедленной предшествующей химической стадией то например: при катодном выделении Н2 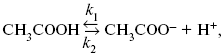
k2 – const молизации, kр = k1/k2. 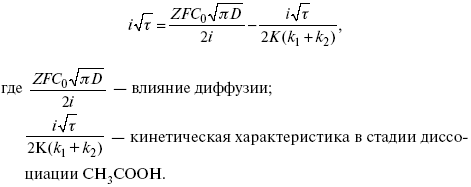
τ в химической стадии будет меньше ∑τ на величину, определяемую const скорости замедленной химической стадии. 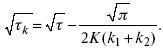
Кроме того, определение переходного времени позволяет графически находить адсорбцию веществ, участвующих в процессе. Количество электричества, определяемое длиной задержки на Е, t кривых, складывается из количества электричества, которое идет на протекание электрохимической реакции и может быть определено через долю τ , связанную с диффузией вещества к поверхности элект-рода и с адсорбцией вещества на электроде
iτ = iτд+ iτадс.
При высоких плотностях тока доля электричества, которое тратится на электрохимическое превращение диффундирующих частиц, → 0.
iτ ≈ iτадс, iτадс = Г
где Г – величина адсорбции.
Смотрите также
Каучук
...
Свинцовые аккумуляторы
Кислотные свинцовые
аккумуляторы являются наиболее распространенными
среди вторичных
химических источников тока. Обладая сравнительно высокой
мощностью в сочетании
с надежностью и ...
Водные ресурсы
...
