Количественный химический анализ
где сi и Zi - концентрация и заряд i-го иона раствора.
![]() при I £ 10-2;
при I £ 10-2;
![]() при I £ 10-1;
при I £ 10-1;
![]() при I £ 100
при I £ 100
ЗДМ для электролитов
для вышеприведенной обратимой реакции записывается в форме:
![]()
Большинство химических реакций в количественном химическом анализе проводят в растворе, так как этот способ их осуществления наиболее прост и удобен.
Одной из основных характеристик растворов является концентрация. Концентрация
- это величина, показывающая количественное содержание одного вещества в другом в относительных единицах, таких, как:
- процент (%), выражающий число частей данного вещества на 100 частей другого (или всего) вещества;
- промилле (‰, рm) - на тысячу частей;
- пропромилле (‰0, ррm) - на миллион частей;
- пробилле (рв) - на миллиард частей;
- кг/м³, г/см³, моль/дм³, кг/т и др.
Выражение концентрации через рm, ррm, рв используют в основном в фармацевтике (аптекарском деле).
В количественном химическом анализе наиболее часто используют массовую, молярную и процентную концентрации.
В качестве массовой концентрации широко применяется титр раствора. Различают “обыкновенный (простой)” и “условный” (по определяемому веществу) титры.
Простой титр (Т)равен отношению массы растворенного вещества Х к объему его раствора
![]() ,
,
где m(Х) и V(X) - масса вещества Х и объем его раствора соответственно.
В основном в качестве единицы Т(Х) используют г/см³ (г/мл), но иногда пользуются и производными единицами: кг/м³, мг/см³ и др. Выраженный в г/см³ титр показывает, сколько граммов вещества Х содержится в 1см³ его раствора.
Несмотря на одинаковую размерность, титр не следует путать с плотностью! Величина плотности раствора показывает массу одного см³ раствора, а не массу вещества в нем.
Титр по определяемому веществуТ(В/А)
, выраженный в г/см³, показывает, сколько граммов определенного вещества А взаимодействует с 1 см³ стандартного раствора вещества В.
![]() .
.
Условный титр с обыкновенным связан формулой перехода вида:
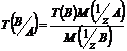 .
.
В аналитической химии используют две молярные концентрации: молярную концентрацию вещества и молярную концентрацию эквивалента вещества.
Молярная концентрация вещества Х
, выраженная в моль/дм³, показывает количество вещества Х, содержащеесяв 1 дм³ (л) его раствора.
![]() ,
,
где n(Х) - количество вещества Х, моль;
V(Х) - объем раствора вещества Х, дм³.
На этикетке молярную концентрацию показывают числом молярных масс вещества, содержащихся в 1 л его раствора. Например, 0,1М Н2SО4, 1М Н2SО4 и т.п.
С титром молярная концентрация связана следующей формулой перехода: ![]() , так как
, так как ![]() ,
,
где М(Х) - молярная масса вещества Х, г/моль.
В формуле связи коэффициент 1000 устраняет разницу в размерностях Т(Х) (г/см³) и с(Х) (моль/дм³).
Молярная концентрация эквивалентавещества Х (бывшая нормальность N), выраженная в моль/дм³ (моль/л), показывает количество эквивалентов вещества Х, содержащееся в 1 дм³ (1 л) его раствора.
![]() ,
,
Смотрите также
Кефир
Кисломолочные продукты - это продукты,
вырабатываемые сквашиванием молока или сливок чистыми культурами молочнокислых
бактерий с добавлением или без добавления дрожжей или уксуснокислых бакт ...
Адсорбционная хроматография
...
Эволюционная химия
Тема
моего реферата: «эволюционная химия – высшая ступень развития химических
знаний». В нем будут рассмотрены вопросы, касающиеся места и роли химии в современной
цивилизации, задачи, конц ...
