Характеристические функции многокомпонентных систем.
Первый и второй законы термодинамики, из которых следуют фундаментальные уравнения, были получены для закрытых систем, т.е. систем, процессы в которых не приводят к изменению количества компонентов. Реально же чаще встречаются системы, в которых при различных процессах изменяются количества компонентов. Это может происходить, скажем, при фазовых превращениях или вследствие протекания химической реакции. При этом может изменяться состав, как отдельных частей, так и системы в целом.
Поэтому внутренняя энергия (и другие функции состояния) открытых систем будут изменяться не только за счет сообщения системе теплоты и произведенной системой работы, но и за счет изменения состава системы. Следовательно для открытых систем характеристические функции будут функциями не только их двух естественных переменных, но и функциями числа молей всех веществ , составляющих систему:
U = U ( S, v, n1……………….nk ),
H = H ( S, p, n1 ………… nk ),
F = F ( T, v, n1…………… nk ),
G = G ( T, p, n1……………nk ).
Полный дифференциал внутренней энергии открытой системы можем записать как: 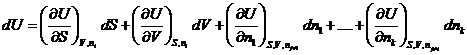 .
.
Индекс nj≠i означает, что число молей других веществ, кроме данного, не изменяется.
Но если открытая система изменяет свое состояние при постоянном составе (все ni =const), то она ничем не отличается от закрытой системы, поэтому:
![]() и
и 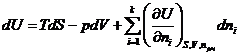 .
.
Гиббс назвал частную производную 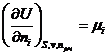 химическим потенциалом i – компонента.
химическим потенциалом i – компонента.
Аналогично: 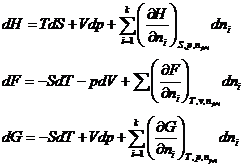 .
.
Поскольку H≡ U + pV, F ≡ U – TS, G ≡ U – TS + pv, то dH = dU + pdV + Vdp, dF = dU – TdS – SdT, dG = dU – TdS – SdT + Vdp + pdV.
и подставив сюда ![]()
получаем: 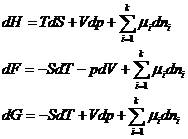
Сравнив выражение для полных дифференциалов характеристических функций, получаем: 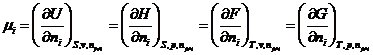 ,
,
т.е. химический потенциал компонента равен приращению характеристической функции системы при добавлении одного моля данного компонента при условии, что естественные переменные и состав системы остаются постоянными, т.е. система достаточно велика.
Смотрите также
Цель работы
Цель данной работы состоит в разработке схемы
переработки вторичного сырья (в данном случае карбидов тугоплавких металлов
режущих инструментов их осколков, кусковые отходы), при заданных
производит ...
