Условия равновесия в многокомпонентных гетерогенных системах.
Пусть р, Т = Const, тогда ![]() . Если в системе имеются фазы (') и (''), то при переходе dni молей i –ого компонента из фазы (') в фазу ('') изменение энергии Гиббса системы dG будет складываться из изменении энергий Гиббса обеих фаз dG ' и dG '':
. Если в системе имеются фазы (') и (''), то при переходе dni молей i –ого компонента из фазы (') в фазу ('') изменение энергии Гиббса системы dG будет складываться из изменении энергий Гиббса обеих фаз dG ' и dG '': ![]() .
.
Если система закрытая, то 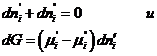 , а если она к тому же и равновесна, то dG = 0 и, следовательно,
, а если она к тому же и равновесна, то dG = 0 и, следовательно, ![]() , т.е. химические потенциалы данного компонента во всех фазах системы, находящейся в равновесии, равны между собой.
, т.е. химические потенциалы данного компонента во всех фазах системы, находящейся в равновесии, равны между собой.
Самопроизвольный неравновесный процесс может идти только в сторону уменьшения энергии Гиббса системы dG < 0 (p, T = const).
Предположим, что ![]() , т.е. фаза (') теряет i –ый компонент, но
, т.е. фаза (') теряет i –ый компонент, но ![]() , значит
, значит ![]() .
.
Если же ![]() , тогда
, тогда ![]() . Таким образом, компонент самопроизвольно переходит из фазы, в которой его химический потенциал больше, в фазу, в которой его химический потенциал меньше.
. Таким образом, компонент самопроизвольно переходит из фазы, в которой его химический потенциал больше, в фазу, в которой его химический потенциал меньше.
Эти условия равновесия и самопроизвольности процессов переноса вещества в многокомпонентных системах являются обобщением таковых для однокомпонентных систем (см. гл. 6). Кроме того, легко заметить, что химический потенциал чистого вещества равен его мольной энергии Гиббса.
Смотрите также
Спирты
...
Возможная схема этапов оптимизации ХТС
Процессы
химической технологии это сложные физико-химические процессы, протекающие как в
пространстве, так и во времени. В них участвуют потоки энергии (тепло и холод)
и многофазные и много ...
Выбор реактора для проведения реакции окисления сернистого ангидрида в серный ангидрид
Задание
Обосновать выбор
реактора для окисления SO2.
Получить
максимальную степень окисления SO2, если изменяются давление, начальная температура и начальная
концентрация (Х ...
