Термодинамика смесей идеальных газов. Характеристические функции идеального газа.
Для адиабатического процесса в системе (Q = 0) мы можем записать ΔU= -A.
Если идеальный газ расширяется адиабатически от объема V и температуры T до бесконечно большого объема, то он совершает работу:
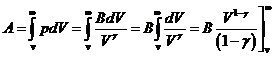 ,
,
а поскольку ![]() , то подстановка верхнего предела дает 0, подстановка нижнего приводит к
, то подстановка верхнего предела дает 0, подстановка нижнего приводит к 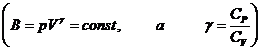 ,
,
![]() .
.
Следовательно ![]() , а поскольку
, а поскольку ![]() , то внутренняя энергия идеального газа, имеющего данную температуру, равна U = CVT.
, то внутренняя энергия идеального газа, имеющего данную температуру, равна U = CVT.
Очевидно, поскольку для идеального газа dU = CV dT, то по первому закону для идеального газа: dQ = CVdT + pdV.
Разделив правую и левую часть на Т, получим ![]() .
.
Интегрирование дает ![]()
![]() .
.
Константа интегрирования S0 не зависит ни от температуры, ни от давления или объема. Как мы увидим позднее для любого вещества в состоянии идеального газа в константу S0 в качестве характеристики вещества входит только его мольная масса. Далее:
H = U + pV = U + RT = CVT +RT = CpT,
F = U – TS = CVT – TS0 - CVT ln T –RT ln V,
G = H – TS = CpT – T( S0 + R ln R ) – CpT ln T + RT ln p,
Легко видеть, что, вообще говоря,
F = F (T) – RT ln V, G = G (T ) + RT ln p,
где F (T) и G (T) - являются функциями только температуры.
Смотрите также
Водные ресурсы
...
Пятая группа периодической системы
По электронным структурам нейтральных атомов
рассматриваемая группа может быть разделена на две подгруппы. Одна из них
включает азот, фосфор, мышьяк и его аналоги, вторая — ванадий и его аналоги.
...
Спирты
...
