Основные принципы взаимодействия атомов.
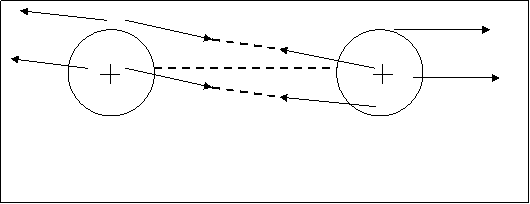
Взаимодействие между атомами происходит через поле. Основным полем является электрическое (электростатическое), т.к. гравитационное и магнитные поля в этом случае ничтожно малы. Рассмотрим частный случай: взаимодействие двух атомов водорода и образование молекулы водорода. Такое взаимодействие показано на рисунке 4.1. Когда атомы удалены друг от друга на большое расстояние, то силы, действующие между ними, равны нулю. При сближении двух атомов водорода между ними возникают два вида сил.
 |
в е в
в а а
в
а
а е
НI HII
Рис.4.1. Возникновение сил притяжения “а” и сил отталки–
вания “в” при сближении двух атомов водорода.
Между электронной оболочкой первого водорода НI и ядром второго водорода HII, так же и между ядром HI и оболочкой HII возникает сила притяжения. Их обозначим буквой а
. В результате притяжения двух атомов водорода энергия между ними (энергия системы из двух атомов) начинает уменьшаться. На энергетической диаграмме (рис.4.2.) это уменьшение энергии показано кривой “а
”. Но наряду с притяжением между двумя атомами водорода возникают силы отталкивания, обусловленные отталкиванием как между одноименно заряженными ядрами обоих атомов водорода, так и между электронными оболочками. Эти силы отталкивания на рис.3.1. показаны стрелками и обозначены буквой “в
”. В результате сил отталкивания энергия системы Н2 будет возрастать. На рисунке 4.2. увеличение энергии системы, вызванное силами отталкивания показано кривой “в
”.
Для получения реальной обобществленной картины изменение энергии системы необходима силы притяжения “а
” и силы отталкивания “в
”, т.е. сложить кривую “а
” и кривую “в
”.
При складывании сил “а
” с силами “в
” получаем результирующую силу “р
”.
![]() р=а+в
р=а+в
На графике (рис.4.2.) результирующая сила даст новую кривую “р
”, показывающую характер изменения энергии системы Н2 в процессе сближения двух атомов водорода. На этой кривой “р
” имеется впадина(r0) которую обычно называют потенциальной ямой. После точки r0 кривая “р
” резко идет вверх, т.е. энергия системы начинает стремительно возрастать. Притяжение двух атомов водорода заканчивается, когда между ними имеется расстояние rс, соответствующее минимальному значению энергии.
 Е
Е
в
НI HII
HII
E0 r
DE p
a
Emin r0
rc
Рис.4.2. Изменение потенциальной энергии системы Н2 при сближении
двух атомов.
Расстояние rc, является расстоянием между двумя центрами двух атомов в молекуле, называют длинной связи.
Из рисунка 4.2. видно, что расстояние меньше rc, чем сумма двух радиусов атомов водорода 2R.
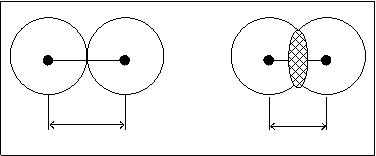 |
rc<2R
R R
2R rc
Рис.4.3.
Cледовательно, в системе двух атомов водорода, т.е. в молекуле водорода произошло перекрывание электронных оболочек взаимодействующих атомов.
Минимальному расстоянию между ядрами атомов водорода в молекуле Н2, т.е. значению rc, соответствует и минимальное значение энергии Emin. В процессе сближения двух атомов водорода происходит уменьшение энергии системы на величину DE. Эта величина может считаться энергией химической связи DE=Есв, т.к. для разрушения молекулы водорода на отдельные атомы необходимо затратить такое же количество энергии.
Из рассмотренного видно, что химическая связь основана на электрическом взаимодействии атомов. Следовательно, природа химической связи носит электростатический характер. В том случае, когда в результате образования молекулы, происходит перекрывание электронных оболочек взаимодействующих атомов (молекула Н2 и др.) на электрические силы химической связи накладываются силы квантового характера, обусловленные увеличением электронной плотности в области перекрывания электронных оболочек взаимодействующих атомов.
Основными характеристиками связи являются: энергия связи (Есв) и длина связи(rc).
Для многоэлектронных атомов и при взаимодействии не двух, а более атомов кривая “р
” не всегда имеет такой вид, как для одноэлектронных атомов. В этом случае энергетические кривые как-то изменяют свои очертания, но ход их сохраняет типичные признаки: остаются нисходящие и восходящие ветви, а так же точки устойчивого равновесия с минимумом потенциальной энергии.
