Метод молекулярных орбиталей.
Метод МО хорошо объясняет и молекулы и молекулярные частицы, состоящие из разных элементов.
Молекула СО.
Оба атома – углерод и кислород – имеют на внешнем уровне одинаковое количество орбиталей, но у углерода на два электрона меньше (углерод:2s22p2; кислород: 2s22p4).
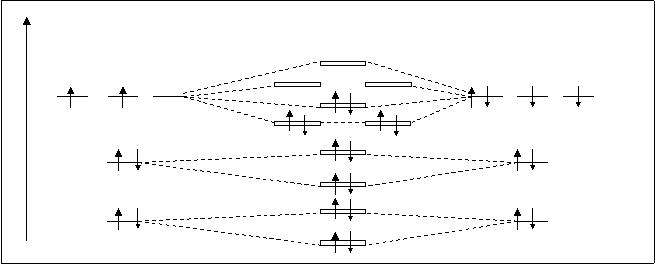 А.О. МО А.О.
А.О. МО А.О.
C CO O
spxраз
ppyраз ppzраз
2P spxсв 2P
ppyсв ppzсв
s2sраз
2S s2sсв 2S s1sраз
1S s1sсв 1S Рис.4.26. Схема расположения молекулярных орбиталей СО.
При взаимодействии атомных орбиталей углерода с атомными орбиталями кислорода получаются молекулярные орбитали СО, аналогичные как по форме, так и по взаимному расположению, орбиталям гомоядерных молекул, например N2. Энергетическая схема молекулы СО показана на рисунке 4.26.
В молекуле СО четырнадцать электронов. Они распределены по МО в соответствии известных трех принципов. На связующих орбиталях находится 10 электронов, а на разрыхляющих – только четыре. Кратность связи равна 3, как у молекулы N2. Следовательно ,молекула СО должна быть очень устойчивой и, в действительности, СО напоминает молекулу N2, энергия диссоциации СО равна 1069 кДж/моль, что на 129 кДж/моль больше, чем энергия диссоциации N2. Можно сказать, что молекула СО изоэлектронная молекуле N2. Электронная формула молекулы следующая: С+О=СО[(s1sсв)2 (s1sраз)2 (s2sсв)2 (s2sраз)2 (ppy,zсв)4 (spxсв)2].
Молекула NO. Энергетическая диаграмма этой молекулы схожа с диаграммой частицы O+2 (табл.4.2.). Схема представлена на рис 4.27.
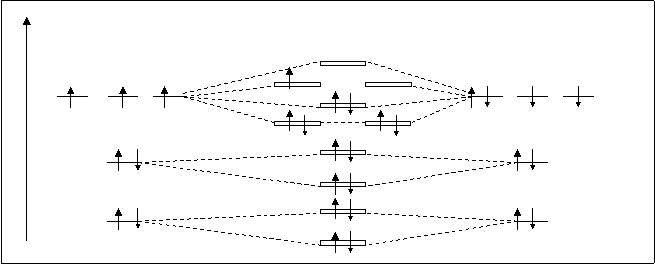 А.О. МО А.О.
А.О. МО А.О.
N NO O
spxраз
ppyраз ppzраз
2P spxсв 2P
ppyсв ppzсв
s2sраз
2S s2sсв 2S s1sраз
1S s1sсв 1S Рис.4.27. Схема расположения молекулярных орбиталей NО.
Молекула NO имеет неспаренный электрон, она парамагнитна. Кратность связи 2,5. Электронная формула NO:
[(s1sсв)2 (s1sраз)2 (s2sсв)2 (s2sраз)2 (ppy,zсв)4 (spxсв)2 (ppy,zраз)1].
Некоторые характеристики гетероядерных молекул и частиц, полученных из элементов второго периода даны в табл.4.3.
Таблица 4.3.
|
Молекула, частица. |
Электронная конфигурация. |
Кратность связи. |
Длина связи, А. |
Энергия диссоциации кДж/моль |
|
BN |
[C2] |
2 |
1,28 |
385 |
|
CN+ |
то же |
2 |
1,17 | |
|
BO |
[N2+] |
2,5 |
1,20 |
800 |
|
CN |
то же |
2,5 |
1,17 |
756 |
|
CO+ |
то же |
2,5 |
1,12 | |
|
NO |
[O2+] |
2,5 |
1,15 |
627 |
|
CN- |
[N2] |
3 |
1,14 |
940 |
|
CO |
то же |
3 |
1,28 |
1069 |
|
NO+ |
то же |
3 |
1,062 |
1048 |
Смотрите также
Подгруппа углерода. Углерод
...
Колебательные химические реакции
...
Пятая группа периодической системы
По электронным структурам нейтральных атомов
рассматриваемая группа может быть разделена на две подгруппы. Одна из них
включает азот, фосфор, мышьяк и его аналоги, вторая — ванадий и его аналоги.
...
