Ионная связь.
Само название связи – ионная – указывает на то, что связь возникает в результате взаимодействия ионов.
Ионной называют такую связь, которая образуется между катионом и анионом в результате их электростатического взаимодействия.
Правомерно встает вопрос, когда химические элементы могут превращаться в положительно и отрицательно заряженные ионы (катионы и анионы).
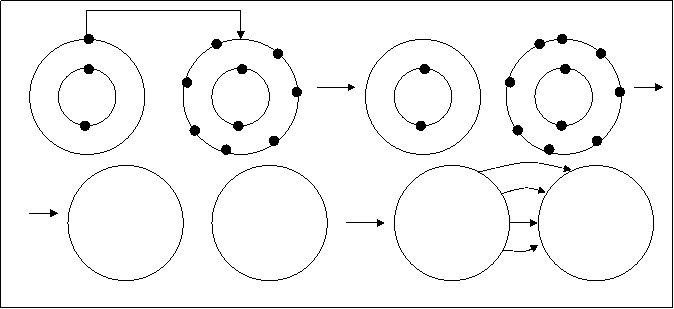
Рассматривая полярную ковалентную связь выяснили, что область перекрывания орбиталей взаимодействующих атомов (т.к. область перекрывания орбиталей дает увеличение электронной плотности создаваемой парой электронов, для простоты будем использовать понятие “электронная пара”), общая электронная пара смещается в сторону более электроотрицательного элемента. Величина полярности молекулы оценивается дипольным моментом m. Из расчета дипольного момента полярных молекул выяснили, что при m >4,8Д полярная ковалентная связь превращается в ионную. В этом случае электрон внешней оболочки одного атома переходит на оболочку более электроотрицательного атома. Такой переход возможен при взаимодействии атома лития с атомом фтора. Это показано на рис.4.32.
Под действием поля атома фтора один электрон из внешней оболочки лития переходит на оболочку фтора. Оба атома приобретают устойчивые оболочки (литий – двухэлектронную оболочку, фтор - восьмиэлектронную оболочку), но при этом оба атома становятся ионами: литий – положительно заряженным – катионом, а фтор - отрицательно заряженным – анионом. Относительная электроотрицательность лития равна 1 (ЕLi=1), а фтора – 4 (ЕF=4). Разность в электроотрицательностях составляет три единицы(DЕ=3). Считается, что полярная ковалентная связь превращается в ионную при разности в электроотрицательностях взаимодействующих атомов более 1,9 единицы.
 |
+3 + +9 +3 + +9
Li F Li+ F—
+ + — + —
Li+ F— LiF
Рис.4.32. Образование ионной молекулы LiF.
![]() Следовательно, эта величина как бы является критерием образования ионной связи. DЕ>1,9.
Следовательно, эта величина как бы является критерием образования ионной связи. DЕ>1,9.
Более точной оценкой степени ионности полярной связи может быть расчет отношения заряда диполя q к заряду электрона е: q/e. Cделаем оценку степени ионности связи в молекуле HCl. При длинные связи l=1,27 А0 и величине заряда диполя q=e=4,8*1010 эл.ст.ед. Расчетное значение дипольного момента будет: mтеор.=l*q= =1,27*10-8 * 4,8*10-10 =6,11Д. Экспериментально определенное значение mэкс.=1,039 Д.
значение mэкс.=1,039 Д. Тогда отношение q к е составит: q/e= mэкс./ mтеор.*100=17%
Степень ионности связи в молекуле НCl всего 17%. Остальные 83% составляет ковалентный характер связи. Обычно считают, что связь является приемущественно ионной, когда степень ионности q/е>50%. При критерии DЕ >1,9 молекула приобретает степень ионности более 50%.
100%-ной ионной связи практически не бывает. Для 100%-ной ионной связи необходимо, чтобы разность в электроотрицательностях элементов DЕ достигла величины 3,5. На самом деле, наиболее крайние по электроотрицательности элементы франция (Fr) и фтора (F) имеют всего DЕ =3,3.
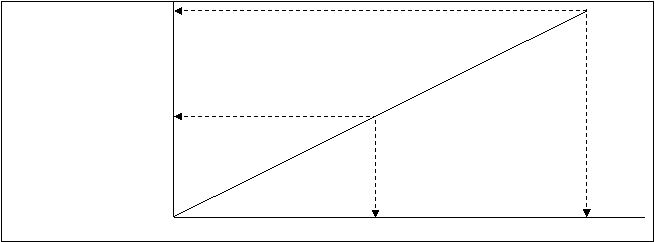 На рис.4.33. дана зависимость степени ионности связи (q/e) от разности в электроотрицательностях атомов DЕ.
На рис.4.33. дана зависимость степени ионности связи (q/e) от разности в электроотрицательностях атомов DЕ.
q/e*100% 100
Рис.4.33. зависи- 90 ионные связи
мость степени 80
ионности связи 70
от разности 60
электроотрица- 50
тельности атомов. 40 ковалентные
30 связи
20
10
