21. Константа диссоциации. Закон разведения Оствальда. Теория растворов сильных электролитов
Количественно электролитическую диссоциацию как равновесный обратимый процесс можно охарактери–зовать константой диссоциации (ионизации), опреде–ляемой законом действующих масс.
Закон действующих масс, строго говоря, применим к обратимым реакциям, т. е. к растворам слабых элект–ролитов. Так, например, диссоциацию электролита KtnAnm можно представить в виде равновесного про–цесса:
Ktn Anm × nKtm+ + mAn- .
Согласно закону действующих масс константу рав–новесия записывают следующим образом:
КД = (Ktm+)n+(Ann-)m + (KtnAnm)
где (Ktm+) и (Ann- ) – молярные равновесные концент–рации ионов электролита;
(KtnAnm) – молярная равновесная концентрация недиссоциированных молекул электролита;
КД – константа равновесия, называемая константой диссоциации.
Данное уравнение справедливо лишь для разбавлен–ных растворов слабых электролитов. При применении его к концентрированным растворам и к растворам силь–ных электролитов уравнение нужно видоизменить.
Чем больше константа диссоциации КД , тем сильнее диссоциирует электролит. В отличие от степени диссо–циации КД зависит только от природы растворителя, электролита и температуры, но не зависит от концент–рации раствора. Таким образом, и константа, и степень электролитической диссоциации – количественные ха–рактеристики диссоциации. Естественно, что между ними существует связь. Многоосновные кислоты и многокислотные основа–ния диссоциируют ступенчато. Например, диссоциация фосфорной кислоты происходит в три ступени: 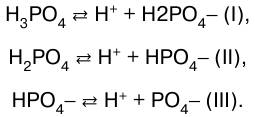
Аналогично для многокислотных оснований (напри–мер, Са(ОН)2) – диссоциация проходит в две ступени.
Ступенчатая диссоциация характеризуется тем, что распад электролита на каждой последующей ступени происходит в меньшей степени, чем на предыдущей. Такой характер изменения констант диссоциации мож–но объяснить электростатическим притяжением на ос–нове закона Кулона. Энергия ионизации минимальна, когда ион отрывается от нейтральной молекулы элек–тролита. Отрыв иона на каждой следующей ступени диссоциации требует возрастающей энергии, так как удаление иона происходит от частицы, заряд которой на последующих ступенях становится больше.
Практически полная диссоциация сильных электроли–тов на ионы вне зависимости от концентрации их раство–ров подтверждается физическими и физико-химиче–скими методами исследования. Так, значения теплоты нейтрализации всех сильных кислот сильными основа–ниями в разбавленных растворах практически одинако–вы. Независимо от природы кислоты и основания по–лучают одинаковое значение АН = –56,5 кДж/моль. Этот факт – наглядное доказательство полной диссо–циации разбавленных растворов кислот и оснований. Во всех случаях общим, протекающим при нейтрали–зации процессом является соединение ионов в моле-
Смотрите также
Возможная схема этапов оптимизации ХТС
Процессы
химической технологии это сложные физико-химические процессы, протекающие как в
пространстве, так и во времени. В них участвуют потоки энергии (тепло и холод)
и многофазные и много ...
Получение фенолов
Наибольшие
количества фенола используются для получения фенолформальдегидных смол, которые
применяются в производстве фенопластов. Большие количества фенола
перерабатывают в циклогексанол, ...
Влияние вида катализатора на параметры синтеза метанола
Метанол известен очень давно, его обнаружили когда перегоняли древесину,
примерно в 17 веке.
Именно процесс сухой перегонки и оставался долгое время единственным
способом его получения.
...
