25. Гидролиз соли
Гидролиз соли
– это взаимодействие соли с мо–лекулами воды, приводящее к образованию малодис-социироваииых соединений.
Процесс гидролиза заключается в переходе протона от молекулы воды к данному иону (СO32- + НОН * НСO3–+ ОН- ) или от данного иона, в том числе от гидратиро-ванного катиона металла, к молекуле воды.
В зависимости от природы соли вода выступает ли–бо как кислота, либо как основание, а соль является соответственно сопряженным основанием или сопря–женной кислотой.
Возможны четыре варианта гидролиза в зависимо–сти от типа соли.
1. Соли, образованные сильной кислотой и слабым основанием: 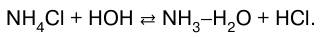
2. Соли, образованные сильным основанием и сла–бой кислотой:
CH3COONa + НОН → СН3СOOН + NaOH.
3. Соли, образованные слабой кислотой и слабым основанием.
Цианид аммония гидролизуется по реакции: 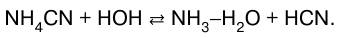
4. Соли, образованные сильной кислотой и сильным основанием.
NaCl, KNO3 гидролизу не подвергаются. Механизм гидролиза солей заключается в поляризационном взаимодействии ионов соли с их гидратной оболоч–кой. Чем сильнее это взаимодействие, тем интенсивнее протекает гидролиз.
Все рассмотренные случаи гидролиза касались солей, образованных однокислотными основаниями и одно– основными кислотами. Соли многоосновных кис–лот и многокислотных оснований гидролизуются ступенчато, образуя при этом кислые и основные соли.
Количественно гидролиз как КО-равновесие характе–ризуется степенью гидролиза и константой гидролиза.
Степень гидролиза измеряется отношением коли–чества гидролизованного вещества к общему коли–честву растворенного вещества.
Степень гидролиза зависит от природы соли, ее кон–центрации и температуры. Согласно закону действую–щих масс степень гидролиза возрастает с разбавлением раствора. Так, при концентрации
Na2CO3 0,001 моль/л степень гидролиза составляет 34%.
В общем случае справедливы следующие законо–мерности.
1. Гидролиз соли должен усиливаться с повыше–нием температуры и разбавлением раствора.
2. При обратимом гидролизе в соответствии с прин–ципом Ле Шателье процесс должен подавляться при подкислении (если эта соль образована сильной кис–лотой и слабым основанием, накапливаются ионы Н) или при подщелачивании (если соль образована сла–бой кислотой и сильным основанием, накапливаются ионы ОН).
3. Гидролиз солей, в результате которого образуются малорастворимые или газообразные продукты, удаляю–щиеся из сферы реакции (принцип смещения равнове–сия), необратим. Например, гидролиз Pb(SO4)2 проте–кает полностью вследствие образования осадка PbO2:
Pb(SO4)2 + 2Н2O → PbO2 + 2H2SO4.
Гидролиз характерен для многих классов неоргани–ческих и органических соединений. Гидролиз неорга–нических соединений важен для оценки их токсично–сти. Гидролиз органических соединений применяют для получения ценных продуктов из древесины, жиров, эфиров и иного, но особенно важную роль гидролиз играет в жизнедеятельности живых организмов.
Смотрите также
Оптимизация химического состава сплава
Целью нашей работы является
нахождение оптимального состава стали М74 для получения наилучших физических
свойств сплава: предела текучести, предела прочности, абсолютного удл ...
Адсорбция полимеров на границе раздела твердое тело - водный раствор
Одним из важнейших разделов физической химии полимеров
и коллоидной .химии в настоящее время является физико-химия поверхностных явлений
в полимерах [1,2]. Это связано с тем, что создание н ...
Жизнь и деятельность академика Григория Алексеевича Разуваева
В данном реферате содержаться
сведения о биографии и научно-исследовательской деятельности в области органической
и металлорганической химии выдающегося советского ученого-химика, Героя Соци ...
