Электролиз
Изучая влияние электрического тока на химические вещества, ученые смогли выделить ряд новых элементов. Вообще за полтора века, прошедшие с того времени, когда Бойль ввел понятие «элемент» (см. гл. 3), было открыто поразительно много веществ, отвечающих этому определению. Более того, было установлено, что некоторые простые и сложные вещества содержат неоткрытые элементы, которые химики не могли пока ни выделить, ни изучить.
Очень часто эти элементы входили в состав оксидов , т. е. соединений кислорода. Чтобы выделить элемент, соединенный с кислородом, последний необходимо было удалить. В принципе под воздействием какого-либо другого элемента, обладающего более сильным сродством к кислороду, атом (или атомы) кислорода может покинуть первый элемент и присоединиться ко второму. Этот метод оказался эффективным. Причем часто роль второго, отнимающего кислород, элемента выполнял углерод. Например, если железную руду, которая по сути является оксидом железа, нагревать на коксе (относительно чистая разновидность углерода), то углерод соединяется с кислородом; при этом образуются оксиды углерода и металлическое железо.
Рассмотрим теперь известь. По своим свойствам она тоже похожа на оксид. Однако ни один из известных тогда элементов, вступая в реакцию с кислородом, не образует известь. Следовательно, известь является оксидом неизвестного элемента. Пытаясь выделить этот неизвестный элемент, известь нагревали на коксе, но при этом ничего не происходило. Неизвестный элемент, по-видимому, так крепко удерживал кислород, что атомы углерода не могли оторвать от него атомы кислорода. Ни одно другое химическое вещество также не могло «заставить» известь отдать кислород.
Однако английский химик Гемфри Дэви (1778—1829) решил, что если вещество нельзя разложить химическим путем, то, возможно, это удастся осуществить под воздействием электрического тока: ведь таким способом удалось разложить даже молекулу воды.
Дэви сконструировал электрическую батарею, в которой насчитывалось более 250 металлических пластин; это была самая сильная из имевшихся в то время батарей. Пропуская ток, который давала эта батарея, через растворы соединений, предположительно содержащих неизвестные элементы, Дэви пытался таким образом выделить эти элементы, однако успеха не добился. Он только разложил воду и получил водород и кислород.
Очевидно, необходимо было прежде удалить воду. Однако через твердые вещества ему даже не удалось пропустить ток. Наконец, Дэви догадался расплавить соединения и пропустить ток через расплав.
Это оказалось действенным. 6 октября 1807 г. Дэви пропустил ток через расплавленный поташ (карбонат калия) и получил маленькие шарики металла, который он назвал потассием (от английского — potash). Этот металл, впоследствии названный калием, оказался очень активным. Он вытеснял кислород из воды, освобождая водород, причем реакция эта шла чрезвычайно бурно. Неделю спустя Дэви выделил из соды (карбоната натрия) содий (от английского — soda), впоследствии названный натрием. По своей активности, как выяснилось, натрий лишь незначительно уступает калию.
В 1808 г., пользуясь модифицированным вариантом метода Берцелиуса, Дэви выделил несколько металлов из их оксидов: магний из магнезии, стронций из оксида стронция, барий из оксида бария и кальций из извести («кальций» — от латинских названий извести — calx, calcis).
Дэви также показал, что зеленоватый газ, который открывший его Шееле (см. гл. 4) считал оксидом, в действительности является элементом. Дэви предложил назвать его хлорин (от греческого χλωρός — желто-зеленый). Позднее Гей-Люссак сократил это название до хлора . Дэви доказал, что соляная кислота, будучи сильной кислотой, не содержит атома кислорода в своей молекуле, и, таким образом, опроверг предположение Лавуазье, который рассматривал кислород как необходимый компонент всех кислот (см. гл. 4.)
Работы Дэви по электролизу продолжил его помощник и ученик Майкл Фарадей (1791—1867) [44], который впоследствии стал знаменитым ученым. Ряд электрохимических терминов, введенных Фарадеем, используется и по сей день (рис. 10). Так, например, он назвал расщепление молекул под действием электрического тока электролизом . По предложению специалиста по античной филологии Уильяма Уэвелла (1794—1866) Фарадей назвал соединение или раствор, способный проводить электрический ток, электролитом ; металлические стержни или пластины, помещенные в расплавленный металл или раствор,— электродами ; электрод, несущий положительный заряд,— анодом ; электрод, несущий отрицательный заряд,— катодом . 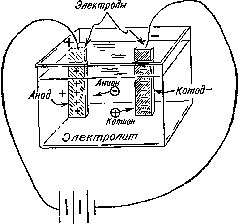
Смотрите также
Нефть
...
Электрохимические методы защиты металлов от коррозии
...
Получение фенолов
Наибольшие
количества фенола используются для получения фенолформальдегидных смол, которые
применяются в производстве фенопластов. Большие количества фенола
перерабатывают в циклогексанол, ...
