Обсуждение результатов.
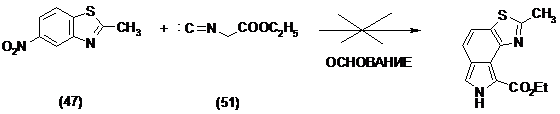
Реакция 2-метил-6-нитробензотиазола и этилового эфира изоциануксусной кислоты.
|
Отношение 2‑метил‑6‑нитробензотиазола к этиловому эфиру изоциануксусной кислоты. |
Растворитель, объем (на 0,1 г 2-метил-6-нитробензотиазола) (мл) |
Основание, отношение к 2‑метил‑6‑нитробензотиазолу |
Условия проведения реакции, обработка. |
|
1:1.1 |
ТГФ абс. , 50 мл |
DBU, 1: 1.1 |
100 часов при комнатной температуре. |
|
1:1.1 |
ТГФ абс. , 50 мл |
DBU, 1: 1.1 |
Кипячение 12 часов. |
|
1:1.1 |
ТГФ абс. , 50 мл |
(Et2N)3P=NEt, 1:1 |
24 часа при 200 и 4 часа при 600, разбавляют CHCl3 и промывают водой. |
|
1:1.1 |
ТГФ абс. , 50 мл |
(Et2N)3P=NEt, 1:2 |
200 часов при 200, разбавляют CHCl3 и промывают водой. |
|
1:1.1 |
ТГФ абс. , 50 мл |
(Et2N)3P=NEt, 1:2 |
200 часов при 500, разбавляют CHCl3 и промывают водой. |
|
1:1.1 |
ТГФ абс. , 40 мл |
NaH, 1:1 |
72 часа при при 200, разбавляют CHCl3 и промывают водой. |
|
1:1.1 |
ТГФ абс. , 40 мл |
NaH, 1:2 |
72 часа при при 200, разбавляют CHCl3 и промывают водой. |
|
1:1.1 |
ТГФ абс. , 40 мл |
NaH, 1:2 |
72 часа при при 500, разбавляют CHCl3 и промывают водой. |
Использование данного подхода было признано не эффективным, таким образом, было решено перейти к второму подходу. Предполагалось присоединить тиазольный или имидазольный фрагмент по b-положениям пиррола. С этой целью необходимо было разработать удобные методы синтеза b,b’-диаминопиррола или b-галоген-b’-аминопиррола. Аминогруппы предполагалось получать путем восстановления нитрогрупп, и задача сводилась к получению нитропирролов.
Первоначально для нитрования был выбран 2,5-диметилпиррол (56), который был синтезирован по следующей схеме:

Алкилирование ацетоуксусного эфира (52) проводили бромацетоном (53), полученным предварительно с выходом 40% при обработке ацетона бромом в водной уксусной кислоте при 700 в течение 2 часов. Алкилирование ацетоуксусного эфира (52) проводили двумя способами: 1) с использованием катализатора межфазного переноса [74]; 2) по стандартной методике с использованием этилата натрия. Выход реакции алкилирования по первому методу составил 20%, а по второму – 53%, поэтому для наработки ацетонилацетоуксусного эфира (54) был выбран последний способ. Полученный ацетонилацетоуксусный эфир (54) декарбоксилировали при кипячении с обратным холодильником в течение 1 часа 20% водным раствором поташа. Выход 2,5-гександиона (55) составил 65%. Замыкание полученного 2,5-гександиона (55) в пиррольный цикл проводили ацетатом аммония в смеси уксусной кислоты и уксусного ангидрида при комнатной температуре в течение 0,5 часа. Выход 2,5-диметилпиррола (56) составил 57%. Нитрование 2,5-диметилпиррола (56) проводили при –550 смесью 92% HNO3 и уксусного ангидрида, однако, даже в таких мягких условиях произошло раскрытие цикла, и в качестве продукта был выделен 2,5-гександион (55). Все синтезированные продукты были охарактеризованы спектральными методами и были определены их физико-химические константы.
Так как известно, что введение акцепторных заместителей приводит к стабилизации пиррольного цикла, поэтому было решено вводить нитрогруппы в пиррол, содержащий акцепторные группы. С этой целью в качестве соединения для введения нитрогрупп был выбран 2,5-диформилпиррол (61).
Смотрите также
Металловедение
Металловедение – наука,. Изучающая строение
и свойства металлов и устанавливающая связь между их составом, строением и
свойствами.
В данном реферате приведены общие и
теоретические сведе ...
Творческая работа по химии: кислород
...
Выводы:
1.
Синтезированы и охарактеризованы бета-дикетонаты
палладия.
2.
Проведено исследование колебател ...
