Скорость химических реакций. Катализ и химическое равновесие
Цель работы
1) ознакомление с основными закономерностями протекания химических реакций и факторами, влияющими на скорость реакции;
2) ознакомление с катализаторами, химическим равновесием и факторами, влияющими на химическое равновесие.
Теоретическая часть
І. Скоростью реакции называется число актов химического взаимодействия, происходящих в единицу времени в единице объёма при гомогенных процессах или на единице поверхности при гетерогенных процессах.
![]()
О средней скорости химической реакции судят по изменению молярной концентрации реагирующих веществ за определённый интервал времени:
![]() ,
,
где ![]() - средняя скорость химической реакции; c1 – молярная концентрация вещества в момент τ1, c2 – молярная концентрация вещества в момент τ2. Истинной скоростью химической реакции в данный момент называется первая производная концентрации по времени:
- средняя скорость химической реакции; c1 – молярная концентрация вещества в момент τ1, c2 – молярная концентрация вещества в момент τ2. Истинной скоростью химической реакции в данный момент называется первая производная концентрации по времени:
![]() .
.
В гомогенной системе скорость химической реакции зависит от природы реагирующих веществ, их концентрации, температуры, наличия катализатора, присутствия примесей и природы растворителя.
В гетерогенной системе взаимодействие осуществляется на поверхности раздела реагирующих веществ, поэтому зависит от диффузии вещества к поверхности (диффузионный режим), а если диффузия не влияет на скорость реакции (кинетический режим), то при прочих равных условиях увеличение поверхности раздела повышает скорость гетерогенной химической реакции.
Зависимость скорости реакции от концентрации определяется законом действующих масс (закон Гульдберга-Вааге):
если химическая реакция идёт в соответствии со стехиометрическим уравнением, то скорость реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции записанной в общем виде, т.е.: nA+mB→qR+pD,
скорость реакции в соответствии с законом действующих масс выразится следующим образом:
(1): ![]() .
.
Здесь [A] и [B] – молярные концентрации реагирующих веществ в данный момент времени;
n и m - стехиометрические коэффициенты при реагирующих веществах. Например, для реакции:
![]()
прямая и обратная скорости:
![]()
На практике приходится иметь дело со сложными процессами, состоящими не из одной, а из множества простых стадий, называемых элементарными актами, для каждой из которых можно записать своё выражение для скорости на основании закона действующих масс. В таком случае число молекул, участвующих в элементарном акте, определяет молекулярность взаимодействия. Для приведённого выше примера прямая реакция тримолекулярна, а обратная бимолекулярна.
В большинстве случаев показатели степени при концентрациях в уравнении закона действующих масс отличаются от числа молекул в уравнении реакции. Это происходит оттого, что уравнение реакции отражает лишь общий итог процесса. Показатели m и n в математическом уравнении (1) называют в таком случае порядком реакции по каждому из реагирующих веществ A или B, а их сумму (m+n) – общим порядком реакции. В каждом конкретном процессе в зависимости от условий может быть различный порядок реакции.
Коэффициент k называется константой скорости реакции и зависит от природы реагирующих веществ, температуры и катализатора. Численно константа скорости химической реакции равна скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л. Однако реакции идут, как правило, по отдельным стадиям и общую скорость процесса определяет наиболее медленно развивающаяся стадия. Поэтому показатели степеней при концентрациях реагирующих веществ не совпадают с их стехиометрическими коэффициентами, а концентрации некоторых из реагирующих веществ вообще могут не входить в выражение скорости химических реакций.
Зависимость константы скорости реакции от температуры может быть выражена уравнением Аррениуса:
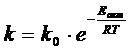 ,
,
где Eакт – энергия активации;
k – константа скорости;
T – температура, К;
k0 – константа;
R – газовая постоянная.
Энергией активации называется то количество энергии, которое надо сообщить молю реагирующих веществ для приведения его в реакционноспособное состояние. Энергия активации в реакции не исчезает и увеличивает тепловой эффект реакции.
При низких температурах можно считать, что скорость реакции возрастает при нагревании на 10˚ в 2…4 раза (правило Вант-Гоффа):
Смотрите также
Строение атома.
На рубеже XIX–XX веков наука вплотную подошла к открытию строения материи. В этот
период, метко названный революцией в естествознании, были сделаны выдающиеся
открытия:
–открытие катодных
лучей ...
Кванты излучения и переходы. Уровни энергии и спектральные переходы в атоме водорода
Квантовая
механика изучает объекты с размерами от 10-7¸10-8
см до
10-16см.
Её
разделы, посвящённые строению вещества:
Квантовая
химия, изучает электронное строение атомно-мо ...
Синтез и анализ ХТС в производстве бензина
Задание
В курсовой работе осуществлён синтез и анализ
химико-технологической системы (ХТС) по производству бензина.
На основе
расходных коэффициентов и соотношения фракций готового про ...
