Карбоновые кислоты. Строение карбоксильной группы. Химические свойства карбоновых кислот. Муравьиная кислота, ее восстановительные способности. Уксусная и стеариновая кислоты, их применение. Олеино
Карбоновыми кислотами называются соединения, содержащие в молекуле группу –СООН , носящую название карбоксильной, происходящее от названий составляющих ее групп: карбонильной –СНО, гидроксильной –ОН. По числу карбоксильных групп кислоты делятся на одноосновные, двухосновные и многоосновные. По характеру радикала – на предельные, непредельные, ароматические и т. д. Изомерия обусловлена строением углеводородного радикала. Для низших членов ряда наиболее употребительны тривиальные названия. Кислоты имеют высокие температуры кипения и плавления, что обусловлено наличием водородных связей. Низшие кислоты обладают острым кислым запахом, высшие запаха не имеют. Низшие кислоты хорошо растворимы в воде, но с увеличением радикала растворимость уменьшается.
Карбоксильная группа содержит в себе карбонильную и гидроксильную группы. Вследствие близкого расположения они оказывают сильное влияние друг на друга. Гидроксогруппа кислот легче отщепляет протон водорода, чем гидроксогруппа спиртов. Причина усиления кислотности – полярная карбонильная группа. Карбонильный атом углерода, несущий положительный заряд, стремится погасить дефицит электронов, притягивая электронные пары не только связей R–C и С=О, но и свободные электронные пары кислорода гидроксильной группы. Поэтому гидроксильный кислород сильнее оттягивает электронную пару связи О–Н (1), усиливая положительный заряд на водороде (2):
1.
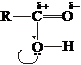
2.
![]()
Химические свойства:
1. RCOOH + NaOH → RCOONa + H2O
2. 2RCOOH + Mg → (RCOO)2Mg + H2
3. RCOONa + HCl(p) → RCOOH + NaCl
H2SO4
4. RCOOH + H2SO4(к) – не идет ( HCOOH —→СO + H2O)
5. Реакция ацилирования:
Путем замещения гидроксильной группы различными группами можно получить функциональные производные кислот: аммиак-аммонийные соли, галогенангидриды, сложные эфиры, амиды, нитрилы и др. При гидролизе всех производных кислот получаются исходные кислоты.
Кислоты находят широкое применение в промышленности. Муравьиная кислота применяется в текстильной и кожевенной промышленности; уксусная – в быту, при производстве специального шелка, красителей, сложных эфиров, ацетона; щавелевая – в крашении, при производстве красителей, в кожевенной промышленности. Высшие кислоты применяются при производстве мыла, каучука и резиновых изделий, линолеума, смазочных масел. Также кислоты широко используются в различных синтезах.
Смотрите также
Витамины. Заболевания при избытке и недостатке витаминов в организме
Витамины — группа низкомолекулярных
органических соединений относительно простого строения и разнообразной
химической природы. Это сборная, в химическом отношении, группа органических
вещес ...
Химия гидразина
Химия гидразина изучается уже почти три четверти века. До 1875 г. были известны только симметричные дизамещенные гидразина— гидразосоединения. В 1875 г. Э. Фишер, исследуя процесс восстановлен ...
Титан
...
