Материальный баланс, определение массы улавливаемого сероводорода и расхода поглотителя
Массу сероводорода, переходящего в процессе абсорбции из газовой смеси в поглотитель за единицу времени, находят из уравнения материального баланса:
![]()
где ![]() - масса улавливаемого компонента,
- масса улавливаемого компонента, ![]() ;
;
![]() - расходы соответственно чистого поглотителя и инертной части газа,
- расходы соответственно чистого поглотителя и инертной части газа, ![]() ;
;
![]() - начальная и конечная концентрация сероводорода в газе,
- начальная и конечная концентрация сероводорода в газе, ![]() ;
;
![]() - начальная и конечная концентрация сероводорода в поглотителе,
- начальная и конечная концентрация сероводорода в поглотителе, ![]() .
.
Проведем пересчет концентраций и нагрузок по фазам в выбранную для расчета размерность:
![]() ,
,
где ![]() - мольная доля сероводорода в газе на входе в абсорбер,
- мольная доля сероводорода в газе на входе в абсорбер, ![]() ;
; ![]() - мольная масса сероводорода,
- мольная масса сероводорода, ![]() ;
; ![]()
![]() [2];
[2]; ![]() - мольная масса воздуха,
- мольная масса воздуха, ![]() ;
; ![]()
![]() [2].
[2].
Поскольку мольная доля любого компонента смеси идеальных газов равна его объемной доли, определим мольную долю сероводорода на входе в абсорбер:
![]() .
.
Тогда
![]()
Конечная концентрация сероводорода в газе рассчитывается из регламентированной степени улавливания по формуле:
![]()
Конечная концентрация абсорбируемого компонента в абсорбенте обуславливает расход поглотителя, который в свою очередь влияет на размеры абсорбера и часть энергетических затрат, связанных с перекачиванием жидкости и ее регенерацией. Конечную концентрацию ![]() можно определить из уравнения материального баланса, выбрав оптимальный коэффициент избытка поглотителя.
можно определить из уравнения материального баланса, выбрав оптимальный коэффициент избытка поглотителя.
Из уравнения материального баланса следует:
![]() ,
,
где ![]() - минимальный массовый расход чистого поглотителя,
- минимальный массовый расход чистого поглотителя, ![]() ;
; ![]() - конечная относительная массовая концентрация сероводорода в поглотителе, равновесная относительной массовой концентрации сероводорода в газе
- конечная относительная массовая концентрация сероводорода в поглотителе, равновесная относительной массовой концентрации сероводорода в газе ![]() ,
, ![]() ;
; ![]() - коэффициент избытка поглотителя. На основании технико-экономических расчетов коэффициент избытка поглотителя принимают равным 1,1 [1]. Отсюда
- коэффициент избытка поглотителя. На основании технико-экономических расчетов коэффициент избытка поглотителя принимают равным 1,1 [1]. Отсюда
![]()
С учетом заданной степени регенерации абсорбера ![]() , определим концентрацию сероводорода в регенерированном поглотителе:
, определим концентрацию сероводорода в регенерированном поглотителе:
![]()
Проверим, не противоречат ли определённые выше параметры ![]() необходимому условию проведения процесса абсорбции наличию движущей силы процесса в любой точке по высоте аппарата, а именно:
необходимому условию проведения процесса абсорбции наличию движущей силы процесса в любой точке по высоте аппарата, а именно:
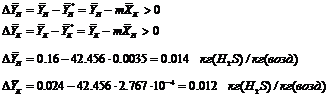
Массовый расход инертной части газа может быть определён из выражения
![]()
где ![]() -- массовый расход инертной части газа,
-- массовый расход инертной части газа, ![]() ;
; ![]() -- объёмный расход газа при нормальных условиях,
-- объёмный расход газа при нормальных условиях, ![]() ;
; ![]() -- средняя плотность инертной части газа при нормальных условиях,
-- средняя плотность инертной части газа при нормальных условиях, ![]() ;
; ![]() где
где ![]() -- средняя плотность газа при нормальных условиях,
-- средняя плотность газа при нормальных условиях, ![]() ;
; ![]() -- объёмная массовая концентрация сероводорода в газе на входе в абсорбер,
-- объёмная массовая концентрация сероводорода в газе на входе в абсорбер, ![]() . Среднюю плотность газа также можно рассчитать, зная его среднюю молекулярную массу из уравнения Менделеева-Клапейрона. Для аммиачного газа при нормальных условиях получим:
. Среднюю плотность газа также можно рассчитать, зная его среднюю молекулярную массу из уравнения Менделеева-Клапейрона. Для аммиачного газа при нормальных условиях получим:
Смотрите также
Четвертая группа периодической системы.
По электронным структурам нейтральных атомов к углероду и
кремнию примыкают германий и его аналоги. Максимальная валентность
этих элементов, как по отдаче, так и по присоединению электро ...
Свойства, применение и получение полиметилметакрилата
...
Общие химические и экологические закономерности.
С чего начинается химия?
Cложный ли это вопрос? На него каждый ответит по-своему.
В середней школе учащиеся изучают химию в течение ряда
лет. Многие довольно хорошо сдают выпускной экзамен по х ...
