2. Термодинамические параметры. Термодинамические показатели. Баланс напряжений
Любая ТДС характеризуется параметрами: температура, давление, плотность, концентрация, мольный объем. В любой ТДС обязательно протекают процессы, и они могут быть равновесными, неравновесными, обратимыми и необратимыми.
Если в ТДС определенное свойство системы не будет изменяться во времени, т. е. оно будет одинаковым во всех точках объема, то такие процессы – равновесные.
В неравновесных процессах свойство системы будет изменяться во времени без воздействия окружающей среды.
Обратимые процессы
– процессы, в которых система возвращается в первоначальное состояние.
Необратимые
– когда система не возвращается в первоначальное состояние.
Функции могут зависеть от пути процесса. Функции, которые зависят от начального и конечного состояний системы и не зависят от пути процесса, – функции состояния; внутренняя энергия, энтальпия, энтропия и другие – полные дифференциалы.
Функции, которые зависят от начального и конечного состояний системы и зависят от пути процесса, не являются функциями состояния и не являются полными дифференциалами Q , A .
Функции можно разделить на две группы: экстенсивные
и интенсивные
.
Экстенсивное свойство
системы прямо пропорционально массе системы и обладает аддитивностью (можно складывать): V , H , Uвн , S , G , F .
Интенсивное свойство
системы не зависит от массы системы и не обладает свойством аддитивности: Q , A , T , P .
Давление
– параметр состояния, определяемый силой, действующей в теле на единицу площади поверхности по нормали к ней. Оно характеризует взаимодействие системы с внешней средой.
Температура
определяет меру интенсивности теплового движения молекул.
Значение градуса температуры и начало ее отсчета произвольны. В качестве эталона можно было бы выбрать не воду, а любое другое вещество (лишь бы его свойства однозначно изменялись с температурой, были воспроизводимы и легко поддавались измерению).
Такая произвольность исчезает, если пользоваться термодинамической (абсолютной) шкалой температур, основанной на втором законе термодинамики. Начальной точкой этой универсальной шкалы является значение предельно низкой температуры – абсолютный нуль, равный 273,15 оС.
Уравнение состояния
Уравнение, связывающее термодинамические параметры системы в равновесном состоянии, – уравнение состояния
.
Вследствие взаимосвязи между свойствами системы для определения ее состояния достаточно указать лишь некоторое число свойств. Так, состояние газа можно считать заданным, если указаны два параметра, например, температура и объем, а значение третьего параметра – давления – можно определить из уравнения состояния
P = f (V , T ),
φ (P , V , T ) = 0.
Графически это уравнение является уравнением поверхности, построенной на трех взаимно перпендикулярных осях, каждая из которых соответствует одному термодинамическому параметру. Таким образом, термодинамическая поверхность
– геометрическое место точек, изображающих равновесные состояния системы в функциях от термодинамических параметров.
Понятие теплоты
Пусть дан изолированный сосуд, который разделен полупроницаемой перегородкой (рис. 1). В первой части сосуда температура Т 1, во второй – температура Т 2; Т 1 > Т 2. 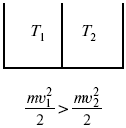
Рис. 1
Молекулы, ударяясь о полупроницаемую перегородку, будут отдавать часть энергии, а другие – принимать ее, без механического перемещения.
Форма передачи энергии от одной части системы к другой называется теплотой
Q.
Мера переданной энергии от одной системы к другой – количество теплоты
Смотрите также
Каучук
...
Полиамиды
Полиамиды - высокомолекулярные соединения,
относящиеся к гетероцепным полимерам, в основной цепи которых содержатся
амидные связи, посредством которых соединены между собой мономерные остатк ...
Биография и научная деятельность Юстуса Либиха
(1803-1873)
...
