2. Концентрация и способы ее выражения
Концентрация
– количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя. При определении концентрации растворов используются различные методы аналитической химии: весовые, объемные, а также методы, основанные на измерении плотности, показателя преломления и других физико-химических свойств.
Виды концентрации
Массовая доля
растворенного вещества в растворе ω , % – отношение массы вещества к массе раствора: 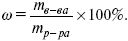
Пример: пусть m (CaCl2) = 10 г, тогда ω (CaCl2) = (10/100) ґ 100% = 10%.
Молярность раствора
– число молей растворенного вещества в одном литре раствора.
Пример: 1 моль H2SO4 – 98 г, до одного литра надо добавить воду.
Моляльность
– число молей растворенного вещества на 1000 г растворителя. Пример:
H2SO4 – 98 г/моль+1000 г H2O.
Мольная доля растворенного вещества в растворе, N 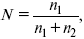
где n 1 – растворенное вещество (моль);
n 2 – растворитель (моль).
Пример: имеем 20% NaOH (едкий натр). 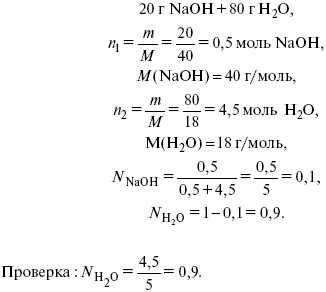
Титр
– число растворенного вещества в одном миллилитре раствора. Существует титриметрический анализ – метод количественного анализа, при котором содержание определяемого вещества Х рассчитывают на основании измерения количества реактива, затраченного на взаимодействие с Х , выполнение реакции в титриметрическом анализе является конечной стадией анализа. Пример: объем кислоты оттитруем щелочью каплями до исчезновения окрас-ки – полная нейтрализация. При титровании 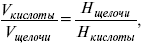
где Н – нормальность – число моль-эквивалентов растворенного вещества в одном литре раствора.
Основной характеристикой растворов является их растворимость
– масса вещества, способная раствориться в ста граммах растворителя при данной температуре; этот процесс сопровождается тепловым эффектом. Количественно растворимость твердого тела, газа, жидкости в жидком растворителе определяется концентрацией насыщенного раствора при данной температуре, т. е. сколько вещества по массе (объему) в данном растворителе. Пример: m (NaCl) – 58,5 г на 100 г H2O при данной температуре. Насыщенный раствор
– раствор, находящийся в равновесии, с избытком растворяемого вещества. Пересыщенный
– неустойчивый раствор, содержащий больше вещества, чем это определяется его растворимостью.
Качественная характеристика состоит в способности растворяться или не растворяться, например, сера в воде не растворяется, йод в воде практически нерастворим. Процесс растворения состоит из двух стадий:
1. Растворимость в воде твердых веществ (разрушение кристаллов – эндотермическая реакция, т. е. тепло поглощается –q 1).
2. Отдельные частицы взаимодействуют с водой, этот процесс носит название – гидратация
, при ней тепло выделяется +q 2
Q раствореия = –q 1 + q 2.
Если –q 1 > q 2, то суммарный эффект отрицателен (–Q ), если наоборот, то положителен (+Q ).
ΔH = 0 – одинаковые эффекты, ΔH < 0 – тепло выделяется, ΔH > 0 – тепло поглощается.
Тепловой эффект растворения
– количество тепла одного моля вещества.
вещество + растворитель ↔ насыщенный раствор + Q.
То вещество, которое растворяется с понижением температуры, увеличивает свою растворимость. Рассмотрим растворимость некоторых веществ. Пример, NH4NO3 – нитрат аммония, растворимость падает до нуля, эндотермический эффект реакции. Рассмотрим стадии подробно: на первой стадии – эффект разрушения кристаллической решетки, эндотермический. На второй – равномерное распределение по объему с водой, гидратация – экзотермический.
q 1 > q 2 → – Q – тепло поглощается,
ΔH > 0.
Другой пример, NaOH – едкий натр, экзотермический эффект реакции,
q 1 < q 2 → +Q – тепло выделяется.
Значит, растворимость определяется природой соли вещества и растворителя.
Другой характеристикой растворов является диэлектрическая проницаемость
– во сколько раз сила взаимодействия между двумя зарядами меньше, чем в вакууме.
Если растворить в ста миллилитрах водопроводной воды 10 г едкого натра NaOH, то температура резко повышается до 60 oС (температура воды из водопроводного крана +20 oС).
