4. Растворы неэлектролитов. Закон Рауля и его следствия
Рассмотрим модель идеального раствора. Раствор называется идеальным, если в нем отсутствует взаимодействие между частицами (молекулами, атомами, ионами). Растворы неэлектролитов
– частицы, плохо растворимые в воде, так как нет носителя электрического заряда. Закон Рауля справедлив только для разбавленных растворов неэлектролитов.
Пусть PBO – давление пара над чистым растворителем, при постоянной температуре T 1; PB – давление пара растворителя при этой же температуре, но над раствором, состоящим из нелетучего компонента А (сахар), и чистым жидким растворителем В :
PB = f (T ).
Разность PBO – PB равна понижению давления пара.
Величина (PBO – PB) /PBO – относительное понижение упругости пара = XA = ΔP/PBO , где XA – мольная доля, PBO > PB, ΔP = PBO – PB – абсолютное понижение упругости пара.
Закон Рауля.
Относительное понижение упругости пара растворителя над раствором равно мольной доле растворенного нелетучего компонента. 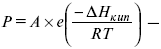
барометрическая формула Больцмана.
Следствия из закона Рауля:
1. Растворение нелетучего компонента в растворителе приводит к расширению температурной области существования жидкой фазы.
2. Понижение температуры замерзания и повышение температуры кипения прямо пропорциональны моляльной концентрации растворенного вещества.
3. Растворы, содержащие одинаковое число молей растворенных веществ в одинаковых молях растворителя, обнаруживают одно и то же понижение температуры замерзания и одно и то же повышение температуры кипения.
Δtкип=Э x Смоляльн,
где Э – эбуллиоскопическая константа, +0,52.
Δtзам=К x Смоляльн,
где К – криоскопическая константа, равная –1,86.
Эбуллиоскопическая константа
– разница между температурой кипения раствора и температурой чистого растворителя.
Криоскопическая константа
– разница между температурой замерзания раствора и температурой чистого растворителя.
Для решения задач об этих константах необходимо знать массу растворенного вещества и массу раствора. Например, масса хлороформа (трихлорметан CHCl3) рассчитывается по формуле: 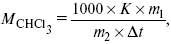
где m 1 – масса растворенного вещества;
m 2 – масса растворителя;
Δt – величина, показывающая на сколько градусов понизилась температура;
К – криоскопическая константа.
Смотрите также
Химия и запахи
...
Жизнь и деятельность Д.И. Менделеева. Периодический закон
Периодический
закон и Периодическая система химических элементов Д.И. Менделеева – основа
современной химии. Да и остальные открытия ученого по сей день не потеряли
своего значения.
Дмит ...
Графический метод решения химических задач
Решение расчетных
задач – важнейшая составная часть школьного предмета «химия», так как это один
из приёмов обучения, посредством которого обеспечивается более глубокое и
полное усвоение уч ...
