Особенности кинетики реакций на поверхности гетерогенных катализаторов
Рассмотрим подробнее применение закона действия масс для реакций на поверхности. Для описания скорости элементарной стадии используют закон действия поверхностей. Если процесс определяется скоростью реакции двух поверхностных интермедиатов (Аадс + Вадс →, ZA + ZB →, 2ZA →) скорость такой стадии, например,
![]() (27)
(27)
запишем через концентрации поверхностных веществ ![]() и
и ![]() (моль/м2)
(моль/м2)
![]() моль·м–2·сек–1 (28)
моль·м–2·сек–1 (28)
Удельная скорость стадии (на 1 г катализатора)
![]() моль·г–1·сек–1 (29)
моль·г–1·сек–1 (29)
где S – удельная поверхность, м2/г.
Выразим величины ![]() и
и ![]() через относительные концентрации, доли занятой
поверхности
через относительные концентрации, доли занятой
поверхности
![]()
![]()
где ![]() – максимальная концентрация поверхностных
центров, занимаемых молекулами А, В или С. Тогда
– максимальная концентрация поверхностных
центров, занимаемых молекулами А, В или С. Тогда
![]() (30)
(30)
Зная насыпную плотность катализатора (G, г/л), можно пересчитать скорость в молях на 1л катализатора в сек. В жидкофазных процессах с твёрдым катализатором обычно используют значения скорости на 1л раствора. Тогда G есть количество грамм тв. катализатора в 1л раствора
R = WG = kΘAΘB, моль·л–1·сек–1, (31)
где ![]() .
.
Для однородной поверхности скорость реакции легко записать, выразив ΘA и ΘB через концентрации или парциальные давления реагентов А и В. В случае квазиравновесного приближения
![]() (32)
(32)
(изотерма Лэнгмюра). Тогда, для стадии (27) получим
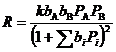 (33)
(33)
Такой тип уравнений называют уравнениями (или моделью) Лэнгмюра – Хиншельвуда и часто используют для описания кинетики гетерогенного катализа при решении прикладных задач. Кинетику реакций на неоднородных поверхностях рассмотрим в следующем разделе.
Смотрите также
Алифатические предельные углеводороды и их строение
Алканы, или
парафины - алифатические предельные углеводороды, в молекулах которых атомы
углерода связаны между собой простой (одинарной) (s-связью.
Оставшиеся
валентности углеродного ато ...
Синтез и анализ ХТС в производстве гидроксида натрия и хлора из водного раствора хлорида натрия
Химическая наука и химическая промышленность в
настоящее время являются одними из ведущих отраслей, которые обеспечивают
научно технический прогресс в обществе. Интенсивный рост данной отрас ...
Синтез 4-метоксифенола
4-Метоксифенол (гидрохинона монометиловый эфир, пара-метоксифенол,
4-Гидроксианизол) – ромбические кристаллы (растворитель перекристаллизации -
вода). Молекулярная масса: 124,14. Температура ...
