Метод валентных связей.
Этот метод базируется на двух идеях:
1). Химическая ковалентная связь возникает в результате перекрывания валентных орбиталей взаимодействующих атомов. Каждая область перекрывания дает одну ковалентную связь. Получающаяся связь является двухцентровой , так как обобществленная электронная пара обслуживает центры (ядра) обоих атомов.
2). Молекула, образованная посредством такой связи, представляет собой конфигурацию, состоящую из двух практически неизменных фиксированных остовов. Под атомным остовом подразумевают ту основную часть атома, которая не принимает участия в образовании связи (т.е. атом без валентных электронов).
Полярность связи. Место валентных связей хорошо и наглядно демонстрирует полярность ковалентной связи. Неполярная ковалентная связь получается тогда, когда область перекрывания валентных орбиталей находится на одинаковом расстоянии от центров взаимодействующих атомов. Примером может служить связь в молекулах Н2 и Cl2.
 |
H2
Cl2
a б а б рис.4.4.
В обеих молекулах область перекрывания двух s-орбиталей (H2) и двух р-орбиталей (Cl2) находится на одинаковых расстояниях от центров двух атомов водорода и атомов хлора (т.е. а=б)
Графически молекулы с неполярной ковалентной связю обозначаются кружочком, в котором положительная и отрицательная полоса совпадают. (рис.4.5.)
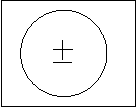 Рис.4.5.
Рис.4.5.
Такая связь образовывается между атомами одного и того же элемента (водорода, кислорода, азота) или атомами различных элементов но с одинаковыми значениями электроотрицательности. Например, связь между бором и теллуром практически неполярна, т.к. у обоих элементов одинаковое значение относительной электроотрицательности (2.01)
Полярная ковалентная связь образуется между атомами с различной электроотрицательностью. В этом случае область перекрывания взаимодействующих атомов смещается в сторону атома с большим значением электроотрицательности.
Такой, например, является связь между атомами в молекулах HCl, CO. В молекуле H–Cl (рис.4.6.) электоротрицательность элементов разная (Ен=2,1; Еcl=2,83)
 |
H : Cl ; а>б
Рис.4.6.
а б
т.к. электоротрицательность хлора больше, то область перекрывания смещена в сторону. Аналогично в молекуле СО (Ес=2,5; Ео=3,5) область перекрывания смещена в сторону более электоротрицательного кислорода.
В молекулах с полярной ковалентной связью центры положительных и отрицательных зарядов не совпадают, в молекуле образуется два полюса: положительный и отрицательный. Такие молекулы называют дипольными (диполями).
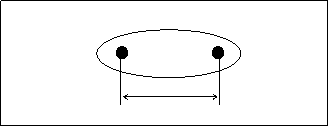
Диполем называют систему, из двух равных по величине, но противоположных по знаку электрических зарядов (q) расположенных на некотором расстоянии друг от друга, называемом длиной диполя (l).
Графически дипольная молекула изображается так, как показано на рис.4.7.
 |
Смотрите также
Синтез изобутилового эфира уксусной кислоты реакцией этерификации
Изобутилацетат (изобутиловый эфир
уксусной кислоты) – бесцветная прозрачная жидкость с фруктовым запахом; хорошо
растворим в органических растворителях, ограниченно растворим в воде. Легко
...
Синтез и свойства адипиновой кислоты
...
Синтез м-нитробензальдегида
Данная
исследовательская работа проведена для получения м-нитробензальдегида и
подробного изучения свойств альдегидов, которые широко используются в промышленности, в органическом
синтезе и ...
