Слабые межмолекулярные взаимодействия.
 Наряду с межмолекулярными водородной и донорно – акцепторной связями между молекулами отдельных соединений могут возникать слабые межмолекулярные взаимодействия. Межмолекулярное взаимодействие приводит к тому, что газообразные вещества при соответствующих условиях могут переходить в жидкое и твердое агрегатное состояние.
Наряду с межмолекулярными водородной и донорно – акцепторной связями между молекулами отдельных соединений могут возникать слабые межмолекулярные взаимодействия. Межмолекулярное взаимодействие приводит к тому, что газообразные вещества при соответствующих условиях могут переходить в жидкое и твердое агрегатное состояние.
d D
0
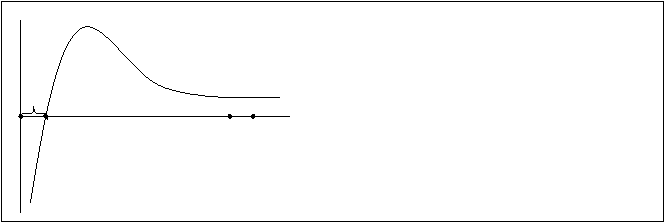
Рис.3.37. Результирующая кривая
межмолекулярного взаимодействия.
Силы притяжения или сцепления между молекулами называют ван–дер–Вальсовыми силами, по имени голландского ученого Ван–дер–Вальса, изучавшего межмолекулярное взаимодействие.
Межмолекулярное взаимодействие зависит прежде всего от расстояния между центрами взаимодействующих молекул. На больших расстояниях ван–дер–вальсовы силы ничтожно малы и начинают проявляться лишь на расстояниях порядка 10А. Если две молекулы приближать друг к другу, то на определенном расстоянии между ними начинают действовать силы притяжения и отталкивания. Соотношение между этими двумя силами можно выразить результирующей кривой (рис.3.37.). Силы притяжения между двумя сближающимися молекулами сначала растут, достигают некоторого максимума, а затем резко уменьшаются в следствии сильного возрастания сил отталкивания. Расстояние между молекулами d0 отвечает равновесному состоянию, когда силы притяжения и отталкивания двух сближающихся молекул уравновешиваются, d0 при этом равно 4–7А. Энергия межмолекулярного взаимодействия невелика и составляет около 8–47 кДж/моль, т.е. в 10–100 раз меньше энергии обычного химического взаимодействия.
Молекулы как валентнонасыщенные частицы не могут образовывать между собой валентных связей. Какова тогда природа ван–дер–Вальсовых сил?
 В А
В А
l d l
l d l
Рис.3.38. Ориентационное дипольное
взаимодействие молекул.
l l
Так как молекулы можно разделить на полярные и неполярные, то возможны три типа взаимодействий:
а) между полярными молекулами (дипольное);
б) между полярной и неполярной молекулами (индукционное);
в) между неполярными молекулами (дисперсионное).
Рассмотрим каждый из этих типов взаимодействий.
Диполное взаимодействие (ориентационное) – это взаимодействие двух полярных молекул. Сущность его сводится к тому, что положительный коней одной молекулы А притягивает к себе отрицательный конец другой В. Переориентировка диполей протекает до тех пор, пока притяжение между ними не уравновесится силами отталкивания (рис.3.38.). В результате взаимодействия диполей потенциальная энергия системы уменьшается, это равносильно усилению связи между молекулами. Чем больше длина диполей l взаимодействующих молекул, тем больше энергия дипольного взаимодействия. Так как тепловое движение молекул нарушает ориентацию, то естественно повышение температуры ослабляет связи ориентационного (дипольного) взаимодействия.
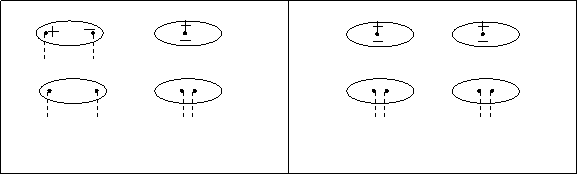
![]() Индукционное взаимодействие – взаимодействие полярной и неполярной молекул. В неполярной молекуле значение постоянного дипольного момента равно нулю mр=0. Под действием электрического поля полярной молекулы может индуцироваться в неполярной молекуле диполь с mi =0 и и последняя становится индуцированно–полярной. Между постоянным диполем молекулы А индуцированным диполем молекулы В возникает индуционное взаимодействие (рис.42.). Не все полярные молекулы обладают одинаковой способностью к индуцированию: чем выше поляризуемость молекулы, тем больше величина возникающего в ней индуцированного момента и тем сильнее индукционное взаимодействие.
Индукционное взаимодействие – взаимодействие полярной и неполярной молекул. В неполярной молекуле значение постоянного дипольного момента равно нулю mр=0. Под действием электрического поля полярной молекулы может индуцироваться в неполярной молекуле диполь с mi =0 и и последняя становится индуцированно–полярной. Между постоянным диполем молекулы А индуцированным диполем молекулы В возникает индуционное взаимодействие (рис.42.). Не все полярные молекулы обладают одинаковой способностью к индуцированию: чем выше поляризуемость молекулы, тем больше величина возникающего в ней индуцированного момента и тем сильнее индукционное взаимодействие.
А В
l l=0 l=0 l=0
l li li li
Рис.42. Индукционное взаимо– Рис.43. Дисперсионное взаимо–
действие молекул. действие молекул.
Так как индуцирование приводит к изменению или деформации электронной оболочки молекулы, то этот тип взаимодействия иногда называют деформационным. Индуцирование или деформация неполярной молекулы зависит от напряженности поля полярной молекулы, а поэтому индуцированный эффект не зависит от температуры.
Смотрите также
Альдегиды и кетоны
Это единения, содержащие
карбонильную группу = С = О . У альдегидов карбонил связан радикалом и
водородом. Общая формула альдегидов:
R
– C = O
H
У кетонов карбонил
связан ...
