Кристаллическое состояние.
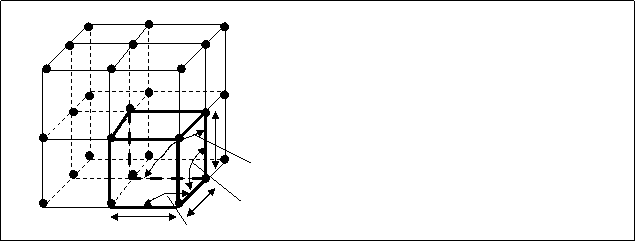
Подавляющее большинство твердых веществ имеют ту или иную кристаллическую структуру. Каждой кристаллической структуре соответствует своя геометрическая форма расположения частиц в пространстве. Кристаллом вещество обычно называют трехмерное его образование, характеризующееся строгой повторяемостью одного и того же элемента структуры (элементарной ячейки) во всех направлениях. Правильная форма кристалла обусловлена упорядоченным расположением составляющих его частиц – атомов, молекул или ионов. Кристаллическая решетка представляет собой пространственный каркас, образованный пересекающимися линиями соединяющими центры тяжести частиц – узлы решетки (рис.5.1.)
 |
в
g
б b Рис.5.1. Кристаллическая решетка.
а a (черные кружочки – узлы решетки).
Каждый маленький объем жирный кубик на рис.5.1., являющийся наименьшим объемом кристалла, назван элементарной ячейкой кристалла. Элементарная ячейка любой формы кристалла содержит определенное число частиц вещества и характеризуется параметром ячейки – длиной ребра (а, б, в) и значениями углов между ними (a, b, g).
В зависимости от природы частиц, образующих кристалл, и характера связи между ними существует четыре типа кристаллических решеток – атомная, ионная, молекулярная и металлическая (рис.5.2.)

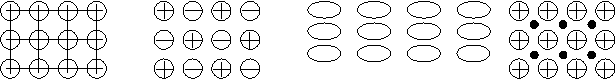 + – + – + – + –
+ – + – + – + –
+ – + – + – + –
+ – + – + – + –
Рис.5.2. Типы кристаллических решеток: а) –атомная; б) –ионная;
в) –молекулярная; г) –металлическая.
а). Атомные решетки. В узлах атомной решетки располагаются (находятся) нейтральные атомы. Связь между атомами осуществляется за счет ковалентных сил. Ковалентные связи многовалентных атомов в их соединениях имеют вполне определенную пространственную ориентацию. Та же ориентация атомов сохраняется и в кристаллической решетке. Таким образом, атомный кристалл можно рассматривать как гигантскую молекулу, все атомы которой связаны ковалентно.
Типичной атомной решеткой является решетка алмаза, состоящей из атомов углерода. Углерод 4-х валентен и его валентные электронные облака ориентированы в пространстве так что образуют между собой углы 109028’’. Каждый атом углерода находится в центре тетраэдра, вершины которого заняты другими четырьмя атомами углерода (рис.5.3.)
 |
Рис. 5.3. Элемент кристаллической
решетки алмаза.
Такая тетраэдрическая структура, которая показана на рис.5.3. распространена по всему кристаллу. Ковалентные силы, действующие в атомных решетках очень велики и по этому такие решетки отличаются большой компактностью. Вещества с атомными решетками близкими к решетке алмаза имеют высокую твердость, высокую температуру плавления и малую летучесть.
Решетки типа алмаза имеет не только углерод, а и другие элементы четвертой группы – кремний, германий, серая модификация олова и ряд бинарных соединений, например, сульфиды (ZnS, CdS и др.)
б) Ионные решетки. Ионная решетка характеризуется наличием в узлах пространственной решетки отдельных ионов.
Ионные решетки образуются правильным чередованием противоположно заряженных ионов, связанных между собой электростатическими силами притяжения разноименных зарядов. (см. рис.5.2. – б).
Каждый ион, входящий в решетку, находится в совершенно одинаковом отношении ко всем непосредственно окружающим его ионам противоположного знака. Молекулы ионных соединений в результате образования кристаллической решетки теряют свою индивидуальность, весь кристалл ионного соединения представляет собой единую макрочастицу.
Действующие в ионных структурах кулоновские силы обуславливают прочную связь между частицами. Поэтому для ионных кристаллов и температура плавления и твердость значительны. В качестве примера рассмотрим кристаллическую решетку хлорида натрия.

Рис.5.4. Кристаллическая решетка
хлорида натрия. –ионы Na+, –ионы Cl–.
d
Узлы решетки заняты ионами Na+ и Cl–, причем каждый ион Na+ окружен 6-тью ионами Cl–, а каждый ион Cl– окружен 6-тью ионами Na+. (рис.5.4.)
Как видно из рис.5.4., в кристалле NaCl каждый ион Na+ находится в центре октаэдра, шесть вершин которого заняты ионами хлора, так же и ион Cl– окружен октаэдром из шести ионов Na+.
Ионы удерживаются в решетке электростатическими силами. Расстояние между центрами ионов Na+ и Cl– d=2,814 А0.
Смотрите также
Свинец и его свойства
СВИНЕЦ (лат. Plumbum), Pb, химический элемент IV группы периодической
системы Менделеева, атомный номер 82, атомная масса 207,2.
...
Синтез м-нитробензальдегида
Данная
исследовательская работа проведена для получения м-нитробензальдегида и
подробного изучения свойств альдегидов, которые широко используются в промышленности, в органическом
синтезе и ...
К вопросу о металлической связи в плотнейших упаковках химических элементов
Обычно в литературе металлическая связь описывается,
как осуществленная посредством обобществления внешних электронов атомов и не
обладающая свойством направленности. Хотя встречаются попытк ...
