Периодический закон и периодическая система химических элементов Д. И. Менделеева
Периодический закон открыт Д. И. Менделеевым в 1869 году, за основу классификации Менделеев принял атомные массы элементов. Современная формулировка закона: Свойства химических элементов и образуемых ими простых и сложных веществ находятся в периодической зависимости от заряда ядер этих элементов
.
Свойства элементов повторяются периодически, так как периодически повторяется строение внешнего энергетического уровня атомов.
Графическим изображением периодического закона является периодическая таблица. Порядковый номер элемента в периодической таблице соответствует величине заряда ядра атома и количеству электронов в атоме.
Таблица семи периодов: три малых и четыре больших. Периоды – это ряды элементов расположенных в порядке возрастания порядковых номеров, начинающихся щелочным металлом и заканчивающийся инертным газом. 1 – 3 периоды малые (2, 8, 8 элементов). В малых периодах накопление электронов с возрастанием порядкового номера происходит на внешнем уровне.
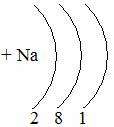
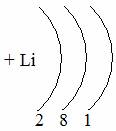
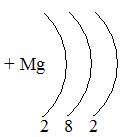
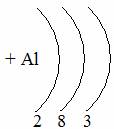
4 – 6 периоды большие. В больших периодах с возрастанием порядкового номера накопление на внешнем уровне происходит у элементов первой, второй группы. Начиная с элемента третьей группы электроны, накапливаются на предпоследнем уровне до 18-ти, а затем возобновляется достройка внешнего уровня до 8-ми электронов.
Большие периоды состоят из двух рядов: чётного и нечётного. Чётные ряды составляют только металлы (1-2 электрона, Cr – 2). В нечётном ряду металлы и неметаллы (1-8 электронов на внешнем уровне).
Металлические свойства в периоде с возрастанием порядкового номера элемента ослабевают, а неметаллические усиливаются, так как радиус атома уменьшается.
Седьмой период не завершён.
Номер периода показывает число энергетических уровней в атоме.
В таблице 8 групп. Группы – это элементы, объединённые в одном вертикальном столбце таблицы. Группы делятся на две подгруппы, в которых объединены элементы со сходным строением внешнего энергетического уровня. В главных подгруппах находятся элементы больших и малых периодов – это s- и p-элементы (заполняются соответственно s- и p-подуровни). В побочных подгруппах находятся элементы только больших периодов f- и d-подуровней (f – лантаноиды и актиноиды). В главных подгруппах расположены металлы и неметаллы. В побочных подгруппах расположены только металлы. Валентные электроны у элементов главной подгруппы расположены в наружном слое. У элементов побочных подгрупп валентные электроны расположены на внешнем и предпоследнем уровне.
Металлические свойства в группе с увеличением порядкового номера элемента усиливаются, так как увеличивается радиус атома. Номер группы показывает высшую валентность элемента и количество электронов на внешнем уровне у элементов главной подгруппы. Элементы побочных подгрупп на внешнем уровне имеют, как правило, один или два электрона.
Смотрите также
Влияние углекислого газа
Деятельность
человека достигла уже такого уровня развития, при котором её влияние на природу
приобретает глобальный характер. Природные системы - атмосфера, суша, океан, -
а также жиз ...
Основы теории и основные понятия процесса хроматографического разделения
Процесс
хроматографического разделения очень сложен, тем не менее, его отдельные стадии могут быть смоделированы и представлены в
виде уравнений, достаточно точно и верно отражающих реальный ...
