Синтезы на основе СО и Н2
Синтез метанола
Процесс синтеза метанола из СО и Н2 был разработан в 1923 г фирмой BASF на катализаторах ZnO-Cr2O3-Al2O3 (температуры 320 – 400оС, Р = 250 – 350 атм). В начале 70х были разработаны медноцинковые катализаторы низкого давления (ZnO-CuO-Al2O3), работающие при 230 – 280оС и 50 – 100 атмосферах синтез-газа. Процесс характеризуется высокой активностью и селективностью. При объемной скорости 10000 – 12000 час–1 на цинкхромовых контактах получается ~ 2кг метанола с 1л катализатора в час.
Стехиометрия процесса описывается реакцией (15)
![]()
![]() кДж/моль (15)
кДж/моль (15)
Вместе с тем исходная шихта, подаваемая в реактор, содержит 8 – 11% СО2, 16 – 21% СО и 67% Н2. Известно, что СО2 также подвергается гидрированию до метанола в условиях процесса
![]()
![]() кДж/моль (16)
кДж/моль (16)
однако синтез-газ (СО + Н2), не содержащий СО2 и воды, плохо превращается в метанол. Использование меченого 14СО2 и метода относительных селективностей (SCH3OH/SCO2) показало, что процесс на цинкмедных катализаторах протекает по схеме (Ю.Каган, Е.Сливинский, А.Розовский, 1975 – 1980 гг):
![]()
Если в системе есть вода, но нет СО2, протекают реакции
![]() (17)
(17)
![]() , (16)
, (16)
в которых вода выполняет роль катализатора. Если в системе есть СО2 (по СО2 наблюдается экстремум), протекают те же реакции
![]() (16)
(16)
![]() , (17)
, (17)
но в другом порядке и катализатором в отношении реакции (15) является СО2. Сухой газ (СО + Н2) без СО2 не превращается в метанол. На Fe-содержащем катализаторе возможен и прямой маршрут через СО.
Процесс синтеза метанола очень показателен в отношении развития кинетических моделей и представлений о механизме процесса.
Кинетические модели первого поколения исходили из представлений об однородной поверхности цинкхромового катализатора, и лимитирующей стадией считали взаимодействие адсорбированных молекул СО и Н2 (Д.Натта, 1953, I.Pasquon, 1960)
![]()
Для обратимого процесса с 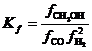 (fi – летучести) скорость описывали уравнением (18)
(fi – летучести) скорость описывали уравнением (18)
 (18)
(18)
В начале 70х появились модели, учитывающие неоднородность поверхности катализатора(В.Леонов, 1973)
 , (19)
, (19)
Уравнение (19) получено в предположении лимитирующей стадии адсорбции водорода
![]()
Уравнения (18) и (19) не учитывали необходимость в оптимальном PCO2 и тормозящую роль воды. После открытия роли СО2 в этом процессе вернулись к модели однородной поверхности, но с влиянием воды и СО2.
Смотрите также
Результаты ТД расчета и экспериментального исследования
системы Аl - АГСВ - каталитические
добавки
В данной главе
представлены данные термодинамического расчета характеристик базовых систем и
экспериментальные характеристики зажигания и горения исследуемых систем. ...
Получение фенолов
Наибольшие
количества фенола используются для получения фенолформальдегидных смол, которые
применяются в производстве фенопластов. Большие количества фенола
перерабатывают в циклогексанол, ...
Биохимия углеводов в организме человека
Важнейшими
химическими соединениями живых организмов являются углеводы. Они широко
распространены в природе, в растительном мире они составляют 70-80% из расчета
на сухое вещество, у животн ...
