5. Процессы. Второй закон термодинамики
Это пятое уравнение второго закона термодинамики для обратимого процесса.
Интеграл по замкнутому контуру – интеграл Клаузиуса.
При необратимом процессе: 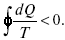
Это шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0. 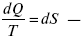
это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S.
S = k lnW.
Действие, обратное логарифму – потенцирование
: 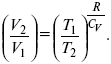
Первый закон термодинамики определяется постоянством функции U в изолированной системе. Найдем функцию, выражающую содержание второго закона, а именно, одностороннюю направленность протекающих в изолированной системе процессов. Изменение искомой функции должно иметь для всех реальных, т. е. необратимых процессов, протекающих в изолированных системах, один и тот же знак. Второй закон термодинамики в приложении к некруговым необратимым процессам должен выражатся неравенством. Вспомним Цикл Карно. Так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, то выражение: 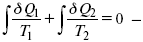
справедливо для любого обратимого цикла. Считая на каждом элементарном участке теплообмена Т = const, найдем, что: 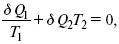
и для всего цикла 
или 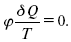
Энергия Гельмгольца Изохорно-изотермический потенциал
F = U – TS
Величина (V – TS ) является свойством системы; она называется энергией Гельмгольца
. Была введена Гельмгольцем
в 1882 г.
dF = dU – TdS – SdT,
U = F + TS,
dF = TdS – pdV – SdT,
F – полный дифференциал. 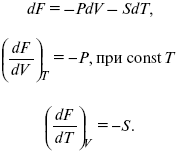
Увеличение объема приводит к тому, что изохорно-изотермический потенциал уменьшается (тот «минус», который стоит перед Р ). Повышение температуры приводит к тому, что F уменьшается.
δА равн> δА неравн
Q = ΔU + A,
A = Q – ΔU,
A = T(S2 – S1) – (U2 – U1),
А = F1 – F2 = – ΔF,
А равн= – ΔF –
физический смысл изохорно-изотермического потенциала.
Убыль изохорно-изотермического потенциала равна максимальной работе, производимой системой в этом процессе; F – критерий направленности самопроизвольного процесса в изолированной системе
. Для самопроизвольного процесса: AFTг< 0.
Для несамопроизвольного процесса: ΔFT,V > 0. Для равновесного процесса: ΔFT,V = 0.
ΔFV,T ≤ 0.
Изохорно-изотермический потенциал в самопроизвольных процессах уменьшается и, когда он достигает своего минимального значения, то наступает состояние равновесия (рис. 4). 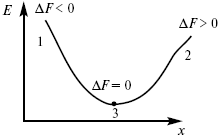
Рис. 4
где 1 – самопроизвольный процесс;
2 – несамопроизвольный процесс;
3 – равновесный процесс.
Изобарно-изотермический потенциал
.
1) G (P, Т= cоnst), энергия Гиббса
G = U – TS + PV = H – TS = F + PV,
δQ = dU – Pdv + A′,
δA′ = Q – dU – pdv,
δA′ max= T(S2 – S1) – (U2 – U1) – p(V2 – V1),
Смотрите также
Витамин С
...
Абсорбционные оптические методы
Абсорбционные
оптические методы. Атомно-абсорбционный анализ. Молекулярно-абсорбционный
анализ. Фотометрия (колориметрия, фотоколориметрия, спектрофотометрия)
Методы
анализа, о ...
