5. Процессы. Второй закон термодинамики
Эти два уравнения являются практически наиболее важными частными случаями общего соотношения:
TdS = CdT.
Пользуясь разными зависимостями, можно вывести другие уравнения, связывающие термодинамические параметры.
Самопроизвольные
– процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, натрий с большой скоростью движется по поверхности, так как идет выделение водорода), а калий буквально «прыгает» по воде.
Несамопроизвольные
– процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Постулаты второго закона термодинамики.
1. Постулат Клаузиуса – «Не может быть перехода тепла от менее нагретого к более нагретому телу».
2. Постулат Томсона – «Теплота наиболее холодного тела не может служить источником работы».
Теорема Карно-Клаузиуса:
«Все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела».
Аналитические выражения второго закона термодинамики.
1. Классическое уравнение второго закона термодинамики 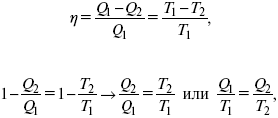
где Q /Т – приведенное тепло;
Q1 /Т1– приведенное тепло нагревателя;
Q2 / T2 – приведенное тепло холодильника;
Q1 /Т1= Q2 / T2 – равенство приведенных теплот нагревателя и холодильника. Это второе уравнение термодинамики. 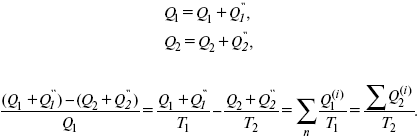
Если делим адиабатами на множество циклов Карно, то получим 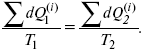
Это третье уравнение второго закона термодинамики для бесконечно малого цикла Карно.
Если процесс является конечным, то 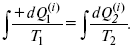
Это четвертое уравнение второго закона термодинамики
Если процесс является замкнутым, то 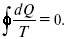
Это пятое уравнение второго закона термодинамики для обратимого процесса.
Интеграл по замкнутому контуру – интеграл Клаузиуса.
При необратимом процессе: 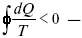
шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0. 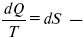
это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S.
S = k lnW.
Термодинамическая вероятность
S = k lnW –
это формула Больцмана,
где S – энтропия – степень разупорядоченности системы;
k– постоянная Больцмана;
W – термодинамическая вероятность системы макросостояний.
Термодинамическая вероятность
– число микросостояний данной системы, с помощью которых можно реализовать данное макросостояние системы (Р, Т, V).
Если W = 1, то S = 0, при температуре абсолютного нуля –273°С все виды движений прекращаются.
Термодинамическая вероятность
– это число способов, которыми атомы и молекулы можно распределить в объеме.
Смотрите также
Энтальпия образования индивидуальных веществ. Прогнозирование энтальпии образования методом Бенсона
Наилучшее решение
вопросов разработки процессов химической технологии и аппаратуры для их
проведения возможно лишь при наличии надежной информации по физико-химическим и
термодинамическим с ...
Алифатические предельные углеводороды и их строение
Алканы, или
парафины - алифатические предельные углеводороды, в молекулах которых атомы
углерода связаны между собой простой (одинарной) (s-связью.
Оставшиеся
валентности углеродного ато ...
