Сера
Некоторые свойства галогенидов серы сопоставлены ниже:
|
SF6 |
S2F10 |
SF5Cl |
SF4 |
S2F2 |
SCl4 |
SCl2 |
S2Cl2 |
S2Br2 | |
|
Агрегатное состояние |
газ |
жидк. |
газ |
газ |
газ |
нест. |
жидк. |
жидк. |
жидк. |
|
Цвет |
бесцв. |
бесцв. |
бесцв. |
бесцв. |
бесцв. |
бесцв. |
красн. |
бесцв. |
красн. |
|
Температура плавления °С |
-50 давл. |
-53 |
-64 |
-121 |
-133 |
-30 |
-121 |
-77 |
-40 |
|
Температура кипения, °С |
-64 возг. |
+29 |
-19 |
-37 |
+15 |
(разл.) |
+60 |
+138 |
+57 (27 Па) |
Большинство этих соединений образуется при взаимодействии элементов и легко разлагается водой.
Из образующихся соединений наиболее интересен газообразный при обычных условиях гексафторид SF6. Он бесцветен, не имеет запаха и не ядовит. От других галогенидов серы SF6 отличается своей исключительной химической инертностью. Как очень хороший газообразный изолятор, он находит применение в высоковольтных установках.
|
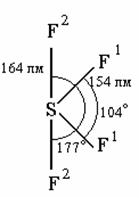
Рис. 7. Строение молекулы SF4. |
Он образуется из элементов с большим выделением тепла (1208 кДж/моль) и термически устойчива до 800 °С. Его критическая температура равна 46 °С при критическом давлении 38 атм. Молекула SF6 неполярна и характеризуется высоким значением потенциала ионизации (19,3 в). Ее сродство к электрону оценивается в 142 кДж/моль. По строению она представляет собой октаэдр с серой в центре [d(SF) = 156 пм]. Средняя энергия связи S-F равна 322 кДж/моль.
Будучи менее всех других газов растворима в воде (примерно 1:200 по объему), гексафторид серы не реагирует не только с ней, но и с растворами NаОН или НСl. Металлическим натрием он разлагается лишь при повышенных температурах (но быстро реагирует при -64 °С с его растворами в жидком аммиаке). С водородом и кислородом SF6 не взаимодействует, но при нагревании ее с Н2S до 400 °С идет реакция по схеме:
SF6 + 3 Н2S = 6 НF + 4 S
Иодистым водородом SF6 легко разлагается по схеме:
SF6 + 8 НI = 6 НF + Н2S + 4I2
уже при 30 °С.
Фторид S2F10 образуется при взаимодействии элементов (теплота образования 2132 кДж/моль) в качестве примеси к SF6. По химическим свойствам S2F10 в общем похож на SF6, но отличается меньшей инертностью и очень ядовит (более, чем фосген). Взаимодействием S2F10 с Сl2, при нагревании может быть получен фторохлорид SF5Cl [d(SF) = 158, d(SСl) = 203 пм]. Он медленно гидролизуется водой и быстро — щелочами.
Тетрафторид серы (теплота образования из элементов 769 кДж/моль, энергия связи SF 339 кДж/моль) может быть получен по проводимой при 200-300 °С под давлением реакции:
S + 2 Cl2 + 4 NaF = 4 NaCl + SF4
Его молекула полярна и имеет строение деформированной тригональной бипирамиды (рис. 7), одна из позиций основания которой как бы заполнена свободной электронной парой атома серы. В отличие от инертного SF6, тетрафторид серы способен образовывать продукты присоединения, является хорошим фторирующим агентом, легко разлагается под действием воды и сильно ядовит. Совместным нагреванием СsF и SF4 (под давлением) был получен СsSF5.
Смотрите также
Водные ресурсы
...
Бром
БРОМ (лат. Bromum), Br - химический
элемент VII группы периодической
системы Менделеева, относится к галогенам, атомный номер 35, атомная
масса 79,904; красно-бурая жидкость с сильным не ...