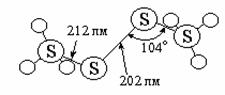
Сера
Значность серы не изменяется также при переходе от SO2 к галогенидным тионилам (SОГ2). Важнейшим из них является хлористый тионил, который может быть получен, например, по реакции:
SO3 + SCl2 Û SOСl2 + SO2
Молекула OSCl2 полярна и имеет форму треугольной пирамиды с атомом серы в вершине [d(SO) = 144, d(SСl) = 208 пм, ÐOSСl = 107°, ÐСlSСl = 96°]. Хлористый тионил представляет собой бесцветную жидкость с резким запахом (т. пл. -100, т. кип. 76 °С). Нагревание выше температуры кипения ведет к его распаду на SO2, S2Cl2 и Сl2.
Жидкий SОСl2 имеет значение диэлектрической проницаемости e = 9 (при обычных температурах) и лишь в ничтожной степени диссоциирован (вероятно, по схеме: SОСl2 + SОСl2 Û SOС1+ + SOСl3-). Он является плохим растворителем типичных солей, но хорошим для многих менее полярных веществ. При действии воды хлористый тионил нацело разлагается с образованием сернистой и соляной кислот: SOCl2 + 2 Н2О = Н2SО3 + 2 НСl. Он применяется при изготовлении красителей, фармацевтических препаратов и т. д. Им удобно пользоваться для получения безводных хлоридов металлов из их кристаллогидратов например, по схеме
СuСl2·2H2O + 2 SOCl2 = 4 НСl+ 2 SO2 + СuСl2
При длительном взаимодействии жидкого диоксида серы с фторидами Сs, Rb, K и Na(но не Li) по схеме МF + SО2 = МSО2F образуются соответствующие фторсульфинаты, по строению подобные хлоратам. Теплоты образования по приведенной реакции солей цезия, рубидия и калия равны соответственно 96, 88 и 75 кДж/моль. Свободная фторсульфиновая кислота (НSO2F) характеризуется точкой плавления -84 °C, но существует лишь в смеси жидких SO2 и НF (полностью смешивающихся друг с другом). При нагревании или под действием воды фторсульфинаты разлагаются.
Химические процессы, сопровождающиеся понижением валентности серы, для диоксида серы малохарактерны. Практически важно быстро идущее в присутствии катализатора (боксит) при 500 °С восстановление SO2 монооксидом углерода:
SO2 + 2 CO = 2 CO2 + S + 268 кДж
используемое иногда для извлечения серы из отходящих газов металлургических заводов.
Другим интересным методом является взаимодействие SO2 с сероводородом по уравнению:
SO2 + 2 H2S = 2 H2O + 3 S + 234 кДж
Реакция эта самопроизвольно протекает уже при обычных условиях, однако с заметной скоростью лишь в присутствии следов (т. е. очень малых количеств иода).
|
Рис. 8. Строение иона S4O62–. |
В присутствии больших количеств воды взаимодействие SО2 и Н2S идет весьма сложно: кроме свободной серы образуется смесь сульфандисульфоновых кислот общей формулы Н2SnO6, обычно называемых политионовыми. Атомы серы в них непосредственно связаны друг с другом, образуя цепочку. В соответствии с этим, например, тетратионовой кислоте отвечает структурная формула НО-SО2-S-S-SO2-OH. Пространственное строение иона S4O62- показано на рис. 8.
В водных растворах политионовые кислоты сильно диссоциированы и постепенно (при обычных температурах очень медленно) гидролитически разлагаются с образованием H2SO4, Н2SО3 и свободной серы. Сами по себе они совершенно неустойчивы, но их бесцветные диэфираты могут быть получены взаимодействием сульфанов с серным ангидридом в эфирной среде при -78 °С по общей схеме:
H2Sn + 2 SO3 +2 (С2Н5)2О = Н2Sn+2O6·2(С2H5)2O
В отличие от свободных кислот вполне устойчивы изученные лучше других солей политионаты калия (с n = 3¸6). Все они хорошо растворимы в воде (примерно 1 : 4 по массе), но нерастворимы в спирте. При последовательном переходе n по ряду 3-6 устойчивость политионатов в кислой среде возрастает, а в щелочной среде быстро уменьшается.
Основные процессы взаимодействия SO2 и Н2S в водной среде могут быть описаны следующими схемами:
SO2 + 2 H2S = 2 H2O + 3 S SO2 + H2O + S = H2S2O3
3 SO2 + H2S = H2S4O6 3 SO2 + H2S + S = H2S5O6
В качестве первоначально возникающего промежуточного продукта принимают образование тиосернистой кислоты, которая может быть получена по схеме
Н2S + SO2 = H2S2O2
при -70 °С, но в обычных условиях разлагается на исходные газы. Обмен группами SО32- и S2O32-, по общей схеме
Н2SnO6 + Н2S2O3 Û Н2Sn+1O6 + Н2SO3
может повести к образованию политионатов с различными значениями n. Следует отметить, что имеются и другие трактовки процесса образования политионовых кислот.
При получении растворов отдельных политионовых кислот исходят обычно из калийных солей, разлагая последние точно рассчитанным количеством какой-либо кислоты, образующей труднорастворимую соль калия (например, НСlO4). Общим исходным сырьем для получения самих политионатов калия служит его тиосульфат — К2S2О3. Реакции их образования протекают по уравнениям:
2 К2S2О3 + 3 SO2 = 2 К2S3О6 + S 2 K2S2O3 + I2 = К2S4O6 + 2 КI
Смотрите также
Этиленгликоль
Спирты представляют собой соединения общей формулы
ROH, в которых гидроксильная группа присоединена к насыщенному атому углерода.
По номенклатуре ИЮПАК насыщенные спирты называют алканолами, ...
Металлы в алхимии
Слово «алхимия» воскрешает в памяти
известную средневековую гравюру, изображающую старца, который трудится в своей
лаборатории среди множества инструментов, один таинственней другого, одержи ...
Атмосферная перегонка нефти
Нефть представляет собой
сложную смесь парафиновых, нафтеновых, ароматических и других углеводородов с
различными молекулярными массами и температурами кипения. Так же в нефти
содержаться с ...