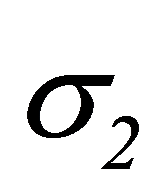Сера
Фторсульфоновая кислота используется главным образом при органических синтезах. Взаимодействие ее с перхлоратом калия при нагревании по уравнению
КСIO4 + НSО3F = КНSО4 +FСlO3
может служить методом получения фторхлортриоксида.
Другой аналог НSO3Сl — бромсульфоновая кислота (НSO3Вг) была получена насыщением раствора SO3 в жидком SO2 сухим НВr при -35 °С. Она представляет собой бледно-желтое вещество, плавящееся около -7 °С с разложением (на Н2SO4, SO2 и Вr2).
Труднее, чем с хлором идёт соединение SO2 с кислородом, хотя сама по себе реакция экзотермична:
SO2 + O2 Û 2 SO3 + 196 кДж.
Процесс с заметной скоростью пропекает только при достаточно высокой температурах и присутствии катализатора.
|
Рис. 9. Равновесие термической диссоциации SO3. |
При быстром сгущении пара триоксида серы образуется бесцветная, похожая на лёд масса, которая затем медленно (быстрее под действием следов воды) переходит в белые шелковистые кристаллы. Обе модификации очень гигроскопичны и дымят на воздухе. Как видно из рис. 9, заметное разложение триоксида серы при нагревании (по реакции, обратимой её образованию) наступает лишь выше 400 °С.
При сжигании серы на воздухе, наряду с SO2 образуется и SO3, но в него переходит менее 4 % от взятой серы. Помимо приведенной в основном тексте реакции, триоксид серы может быть получена термическим разложением Nа2S2O7 или безводного Fе2(SO4)3. Очень чистый SO3 образуется при взаимодействии SО2 с озоном.
Молекула SO3 неполярна и имеет структуру плоского треугольника с атомом серы в центре [d(SO) = 141 пм]. Для энергии и силовой константы связи S=O даются значения 472 кДж/моль.
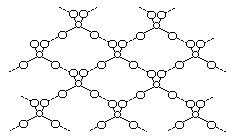
Пар серного ангидрида (и раствор его в SO2) состоит преимущественно из молекул SO3, тогда как в жидкости преобладает смещенное вправо равновесие 3 SO3 Û (SO3)3. Молекулы тримера представляют собой кольца (рис. 10), образованные попеременно расположенными атомами S и O [со средними расстояниями d(S-O) = 161 и d(S=O) = 135 пм]. Из этих кольцевых молекул главным образом и состоит стекловидная a-форма серного ангидрида (т. пл. 17 °С). Основой структуры остальных его форм в твердом состоянии являются зигзагообразные цепи с более или менее значительным числом звеньев, -S(O2)-OS(O2)-O- (рис. 11), по-видимому, изолированные друг от друга у b-формы (т. пл. 32 °С) и спаявшимся в плоские сетки у g-формы (т. пл. 62 °С пол давл.) или в объемные структуры у d-формы (т. пл. 95 °С под давл.). Все модификации серного ангидрида обладают высоким давлением пара и легко возгоняются. Следует отметить, что получить различные формы твердого серного ангидрида в чистом виде весьма трудно и обычно приходится иметь дело с их смесями. Подобными смесями являются и продажные его препараты (белые кристаллы).
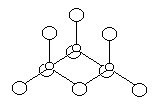
Рис. 10. Схема структуры (SO3)3. Рис. 11. Схема цепи (SO3)n.
Для хранения и транспортировки больших количеств наиболее удобна жидкая форма серного ангидрида (т. кип. 43 °С), которая сама по себе может быть устойчивой лишь при полном исключении даже ничтожных следов влаги. Стабилизация ее достигается введением специальных добавок (SOСl2, В2О3 и др.). При действии измельчённой серы на тщательно защищённый даже от следов воды жидкий SO3 осаждаются зеленовато-синие кристаллы сесквиоксида серы (S2O3). Оксид этот весьма неустойчив и сам по себе, а водой тотчас разлагается с выделением серы. Его самопроизвольный распад при обычных температурах идет в основном по схеме: 2 S2O3 = 3 SO2 + S. Строение его отвечает, вероятно, формуле OS=SO2.
Триоксид серы характеризуется сильными окислительными свойствами (восстанавливаясь обычно до SO2). С другой стороны он является кислотным ангидридом, причём образование H2SO4 из SO3 и воды сопровождается большим выделением тепла:
H2O + SO3 = H2SO4 + 63 кДж
Чистая 100 %-ная серная кислота (моногидрат) представляет собой бесцветную маслянистую жидкость, застывающую в кристаллическую массу при +10 °С. Реактивная серная кислота имеет обычно плотность 1,84 г,см3 и содержит около 95 % H2SO4. Затвердевает она лишь ниже -20 °С.
|
Рис. 12. Схема водородных связей в кристалле H2SO4. |
Моногидрат может быть получен кристаллизацией концентрированной серной кислоты при -10 °С. Образующие его кристалл молекулы (НО)2SO2 соединены друг с другом довольно сильными (25 кДж/моль) водородными связями, как это схематически показано на рис. 12. Сама молекула (НО)2SO2 имеет структуру искаженного тетраэдра с атомом серы около центра и характеризуется следующими параметрами: (d(S-ОН) = 154 пм, ÐНО-S-ОН = 104°, d(S=O) = 143 пм, ÐOSO = 119°. В ионе HOSO3-, d(S-ОН) = 161 и d(SO) = 145 пм, а при переходе к иону SO42- тетраэдр приобретает правильную форму и параметры выравниваются [d(SO) = 148 пм].
Смотрите также
Ртуть
Ртуть (лат. Hudrargyrum) – химический элемент 2 группы
периодической системы Менделеева; атомный номер 80, атомная масса 200,59. Ртуть
– элемент редкий и рассеянный, его содержание примерно ...
Энергетика химических
процессов.
Любой
химический процесс сопровождается тем или иным энергетическим эффектом:
выделение или поглощение теплоты, света, выполнением электрической или
механической работы.
Знание
энергетических э ...
Строительно-монтажная схема здания
цеха и компоновка оборудования
Исходные данные:
1.
Географическое положение и климат:
проектируемая стадия
концентрирования серной кислоты расположена на промышленной площадке завода им.
В.И. ...