Сера
Для серной кислоты известно несколько кристаллогидратов, состав которых показан на рис. 14. Из них наиболее бедный водой представляет собой соль оксония: H3O+HSO4–. Так как рассматриваемая система очень склонна к переохлаждению, фактически наблюдаемые в ней температуры замерзания лежат гораздо ниже температур плавления.
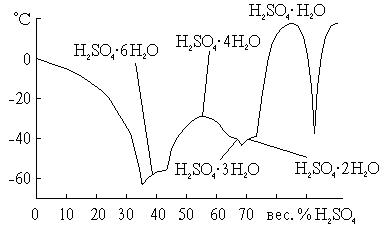
Рис. 14. Температуры плавления в системе H2O·H2SO4.
Изменение плотности водных растворов H2SO4 с её концентрацией (вес. %) дано ниже:
|
5 |
10 |
20 |
30 |
40 |
50 |
60 | |
|
15 °С |
1,033 |
1,068 |
1,142 |
1,222 |
1,307 |
1,399 |
1,502 |
|
25 °С |
1,030 |
1,064 |
1,137 |
1,215 |
1,299 |
1,391 |
1,494 |
|
70 |
80 |
90 |
95 |
97 |
100 | |
|
15 °С |
1,615 |
1,732 |
1,820 |
1,839 |
1,841 |
1,836 |
|
25 °С |
1,606 |
1,722 |
1,809 |
1,829 |
1,831 |
1,827 |
Как видно из этих данных, определение по плотности концентрации серной кислоты выше 90 вес. % становится весьма неточным.
Давление водяного пара над растворами H2SO4 различной концентрации при разных температурах показано на рис. 15. В качестве осушителя серная кислота может действовать лишь до тех пор, пока давление водяного пара над её раствором меньше, чем его парциальное давление в осушаемом газе.
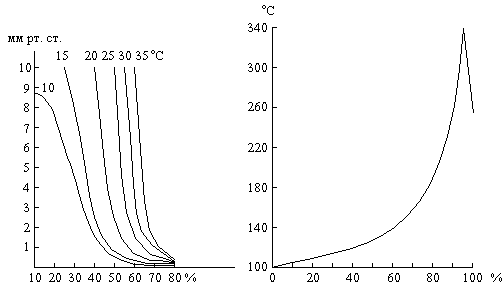
Рис. 15. Давление водяного пара Рис. 16. Температуры кипения над растворами H2SO4. растворов H2SO4.
При кипячении разбавленного раствора серной кислоты из него отгоняется вода, причём температура кипения повышается вплоть до 337 °С, когда начинает перегоняться 98,3 % H2SO4(рис. 16). Напротив, из более концентрированных растворов улетучивается избыток серного ангидрида. Пар кипящей при 337 °С серной кислоты частично диссоциирован на H2O и SO3, которые вновь соединяются при охлаждении. Высокая температура кипения серной кислоты позволяет использовать её для выделения при нагревании легколетучих кислот из их солей (например, HCl из NaCl).
Как сильная двухосновная кислота, H2SO4 даёт два ряда солей: средние (сульфаты) и кислые (гидросульфаты или бисульфаты), причём последние в твёрдом состоянии выделены лишь для немногих самых активных металлов (Na, K и др.). Большинство сернокислых солей бесцветно, хорошо кристаллизуется и легкорастворимо в воде. Из производных наиболее обычных металлов малорастворим CaSO4, ещё менее PbSO4 и практически нерастворим BaSO4.
По отношению к нагреванию сульфаты можно подразделить на две группы. Одни из них (например, соли Na, K, Ba) не разлагаются даже при 1000 °С, другие (например, соли Cu, Al, Fe) разлагаются на оксид металла и SO3 при гораздо более низких температурах. Некоторые, содержащие кристаллизационную воду сульфаты, иногда называют купоросами, например, CuSO4·5H2O — медный купорос, FeSO4·7H2O — железный купорос.
Как кислота H2SO4 в водных растворах близка по силе к хлорноватой в отношении первой стадии ионизации (H2SO4 Û H+ + HSO4–), но вторая стадия (HSO4– Û H+ + SO42–) выражена гораздо слабее и характеризуется значением K2 = 1·10-2. Для зависимости этой константы от температуры имеются следующие данные:
|
Температура, °С |
5 |
15 |
25 |
35 |
100 |
|
K2 |
0,023 |
0,016 |
0,011 |
0,008 |
0,0008 |
Смотрите также
Что такое природный газ?
Еще три
века назад слова “газ” не существовало. Его впервые ввел в XVII веке голландский ученый Ван-Гельмонт. Оно определяло вещество, в
отличии от твердых и жидких тел способное ...
Этилен и его производные в промышленном органическом синтезе
...
Источники возбуждения спектров
В практике
атомно-эмиссионного спектрального анализа в качестве источников возбуждения
спектров применяют пламя, электрические дуги постоянного и переменного тока,
низко- и высоковольтную конденсир ...
