Сера
В основе другого метода улавливания диоксида серы из отходящих газов ( в том числе дымовых) лежит реакция
(NH4)2SO3 + SO2 + H2O Û 2 NH4HSO3
равновесие которой смещается вправо на холоду и затем влево при нагревании под вакуумом. Следует отметить очень значительное поступление диоксида серы в атмосферу при сжигании содержащих серу топлив.
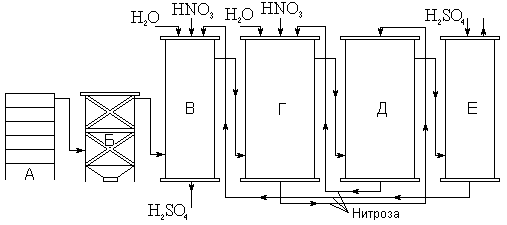
Рис. 19. Схема башенного метода получения серной кислоты.
Нитрозный метод получения H2SO4 был впервые применён в середине XVIII века. Его химическая сущность может быть выражена следующими реакциями:
I. SO2 + H2O + NO2 = H2SO4 + NO II. 2 NO + O2 = 2 NO2
Из первого уравнения видно, что являющийся окислителем диоксид азота NO2 восстанавливается до монооксида NO, а последний при взаимодействии с кислородом воздуха по второму уравнению вновь даёт диоксид. Таким образом, NO играет роль переносчика кислорода, т. е. по существу катализатором реакции окисления SO2 кислородом воздуха.
До 20-х годов текущего века процесс получения серной кислоты нитрозным методом проводился в больших свинцовых камерах (камерный метод). Теперь он осуществляется в специальных башнях (башенный способ). Получаемая по башенному способу кислота, как правило, содержит 76 % H2SO4 и несколько загрязнена различными примесями. Основным потребителем этой кислоты является промышленность минеральных удобрений.
Принципиальная схема башенного способа получения H2SO4 показана на рис. 19. Башни выкладываются из кислотоупорных керамических плит с наружным кожухом из листовой стали. Внутри они неплотно заполнены насадкой из кислотоупорной керамики. Поступающий из печи для сжигания пирита (А) газ освобождается от пыли в электрофильтре (Б) и затем подаётся в продукционные башни (В и Г), где встречается со стекающей сверху “нитрозой”, т. е. раствором оксидов азота в концентрированной серной кислоте. Раствор этот характеризуется следующими равновесиями:
NO + NO2 + 2 H2SO4 Û N2O3 + H2SO4 Û 2 NOHSO4 + H2O
Таким образом, нитроза содержит оксиды азота и химически связанные (в виде HSO3NO2 — т. н. нитрозилсерной кислоты), и просто растворённые. Следует отметить, что окисление SO2 осуществляется только последними. При нагревании приведённые равновесия смещаются влево, при охлаждении — вправо.
В продукционных башнях, куда поступает горячий газ (а также подается вода), нитрозилсерная кислота полностью разлагается и происходит окисление практически всего вводимого сернистого газа. Готовая продукция отбирается из первой башни (В). В поглотительных башнях (Д и Е) происходит улавливание оксидов азота с образованием нитрозы, вновь подаваемой затем в продукционные башни. Выхлопные газы (свободный азот и др.) удаляются через верхнюю часть последней поглотительной башни (Е). Движение газов в системе поддерживается при помощи мощного вентилятора. Для компенсации некоторой потери оксидов азота в продукционные башни вводится азотная кислота.
Другой современный метод получения серной кислоты — контактный — освоен промышленностью лишь в конце прошлого столетия. Основой его является упоминавшаяся выше реакция:
2 SO2 + O2 Û 2 SO3 + 196 кДж
В присутствии платинового катализатора она около 400 °С протекает слева направо практически полностью. Образующийся SO3 улавливают крепкой серной кислотой. Стоимость производства по контактному способу несколько выше, чем по нитрозному, зато серная кислота получается сколь угодно крепкой и очень чистой. Последнее обусловлено тщательной предварительной очисткой образующихся при сжигании пирита газов, что необходимо для обеспечения нормальной работы катализатора. Основными потребителями контактной серной кислоты являются различные химические производства и нефтепромышленность (для очистки нефтепродуктов). Для контактного метода в общей продукции серной кислоты с каждым годом всё более возрастает.
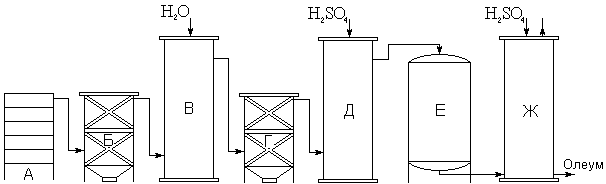
Рис. 20. Схема контактного метода получения серной кислоты.
|
Рис. 21. Выход SO3 на катализаторах контактного метода. |
Принципиальная схема получения серной кислоты контактным способом показана на рис. 20. Образующиеся в печи (А) газы последовательно проходят сквозь сухой электрофильтр (Б), увлажнительную башню (В), влажный электрофильтр (Г), осушительную башню (Д), содержащий катализатор окислительного процесса контактный аппарат (Е) и поглотительную башню (Ж). Из нижней части последней отбирается полученный олеум, а из верхней удаляются выхлопные газы (азот и др.). Большинство контактных заводов работает в настоящее время не с платиновыми, а со значительно более дешёвыми ванадиевыми катализаторами (V2O5, Ag3VO4 и др.), активность которых при реакции образования SO3 также весьма велика (рис. 21). Чаще всего применяют V2O5 с различными добавками (SiO2, KOH и др.).