Сера
2 Na2SO3 + O2 = 2 Na2SO4
Несравненно быстрее (практически моментально) протекает окисление сернистой кислоты и сульфитов при действии таких окислителей, как КMnO4, Br2, I2 и т. п. В результате окисления образуется серная кислота или её соль.
Окисление растворов Н2SO3 и ее солей кислородом воздуха сопровождается ультрафиолетовым излучением с длиной волны около 220 нм. Данный процесс является, по-видимому, цепной реакцией, причем возникновение цепей связано с каталитическим влиянием примесей. В пользу этого говорит то обстоятельство, что скорость окисления тем меньше, чем тщательнее очищена взятая для растворения вода. Напротив, при прибавлении к раствору следов солей Fе, Сu и т. д. она сильно возрастает. С другой стороны, окисление сульфитов кислородом воздуха может быть сведено почти на нет добавкой к раствору незначительных количеств спирта, глицерина, SnСl2 и т. п. Задерживающее влияние небольших добавок некоторых веществ на окисление других кислородом воздуха носит название “антиокислительного катализа”. Явление это иногда практически используется в производстве органических препаратов.
Из отдельных процессов окисления сернистой кислоты заслуживает специального упоминания ее реакция с НIO3, позволяющая наглядно наблюдать зависимость скорости химического взаимодействия от концентрации и температуры. Суммарно она может быть выражена уравнением
НIO3 + 3 Н2SO3 = 3 Н2SO4 + НI
На самом деле реакция идет этим прямым путем лишь в первый момент, а после появления в растворе НI параллельно протекают следующие процессы:
HIO3 + 5 HI = 3 I2 + 3 H2O 3I2+3H2SO3+3H2O = 3 H2SO4 + 6 HI
Из них второй осуществляется быстрее первого. Поэтому иод может появиться в растворе лишь после полного окисления сернистой кислоты. Момент этот определяется по синему окрашиванию прибавляемого к смеси крахмала.
Рассматриваемая реакция интересна во многих отношениях. Прежде всего она дает пример протекающей в растворе цепной реакции: процесс по первому уравнению создает цепь, процессы по обоим следующим участвуют в ее развертывании. Затем она может служить примером аутокаталитической реакции, так как образующийся при ее протекании ион I’ ускоряет весь процесс (что легко установить, добавив к исходной смеси немного КI). Наконец, на ней же удобно проследить действие так называемых отрицательных катализаторов — веществ, добавка которых в небольших количествах существенно уменьшает скорость реакций. Таким веществом является в данном случае НgСl2, добавка которой к смеси заметно замедляет процесс.
Наряду с кислородом сульфиты способны присоединять также серу, переходя при этом в соли тиосерной кислоты, например по реакции:
Na2SO3 + S = Na2S2O3
Как и в случае кислорода, присоединение серы идёт медленно и для получения тиосульфатов приходится подвергать реакционную смесь кипячению.
Тиосерной кислоте отвечает формула:
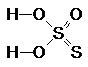 или
или 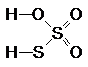
Какая из них более правильна, пока неясно. И в той, и в другой молекуле атомы серы имеют разную степень окисления (+6 и -2). Это следует учитывать при составлении уравнений реакций, протекающих с участием Н2S2O3 и её солей.
По силе тиосерная кислота близка к серной, но в свободном состоянии она неустойчива и при выделении (путём подкисления растворов солей) распадается на сернистую кислоту и серу. Напротив, многие её соли (из которых известны лишь средние) устойчивы. Как правило они бесцветны и хорошо растворимы в воде. Наибольшее значение имеет тиосульфат натрия (гипосульфит) Na2S2O3·5H2O. Соль эта используется главным образом в фотографии и как сильный восстановитель, легко окисляющийся, например, по реакции:
Na2S2O3 + 4 Cl2 + 5 H2O = 2 H2SO4 + 2 NaCl + 6 HСl
Гипосульфит используется также в медицине.
Свободная серноватистая кислота может быть получена взаимодействием при -78 °С хлорсульфоновой кислоты с сероводородом по схеме:
НSО3С1 + Н2S = НСl + Н2S2O3
Она представляет собой маслянистую жидкость, при охлаждении жидким воздухом застывающую в стеклообразную массу. Заметное разложение серноватистой кислоты по схеме:
2 Н2S2O3 = Н2S + Н2S3О6
идет даже при -78 °С. Значительно устойчивее ее диэфират — Н2S2O3·2(С2Н5)2O, разлагающийся (на Н2S, SO3 и эфир) лишь выше -5 °С. Ион S2О32- имеет структуру тетраэдра с одним атомом серы около центра и другим на периферии [d(SS) = 148, d(SS) = 197 пм]. Результаты определения второй константы диссоциации серноватистой кислоты (К2 = 2·10-2) говорят о том, что она даже несколько сильнее серной (К2 = 1·10-2). При подкислении раствора Nа2S2O3 распад по схеме НS2O3’® НSО3’+ S наступает уже около рН = 4,5. Если раствор Na2S2O3 вводить по каплям в кипящую концентрированную НСl, происходит распад серноватистой кислоты по схеме:
H2S2О3 +Н2O = Н2S + Н2SО4
Интересен химизм получения гипосульфита путем взаимодействия серы со щелочью. Реакция эта в первой стадии протекает с одновременным окислением и восстановлением серы, т. е. аналогично соответствующим реакциям галогенов:
Смотрите также
Физико-химические свойства нефтей
...
Введение
Физическая химия – наука, объясняющая химические
явления и устанавливающая их закономерности на основе общих принципов физики.
Общая задача физической химии – предсказание
временного хода химичес ...
Хром
К металлам побочных подгрупп периодической системы Д. И. Менделеева
относятся все d-элементы. Таких
подгрупп 10: скандия, титана, ванадия, хрома, марганца ...
