Сера
Уже при очень малых концентрациях диоксид серы создаёт неприятный вкус во рту и раздражает слизистые оболочки. Вдыхание воздуха, содержащего более 0,2 % SO2, вызывает хрипоту, одышку и быструю потерю сознания. Чувствительность отдельных людей к сернистому газу весьма различна, причём по мере привыкания к нему она заметно понижается. Хроническое отравление сернистым газом ведёт к потере аппетита, запорам и воспалению дыхательных путей. Максимально допустимой концентрацией SO2 в воздухе производственных помещений считается 0,01 мг/л. Содержащие SO2 баллоны должны иметь чёрную окраску с белой надписью “Сернистый ангидрид” и жёлтой чертой под ней.
Интересно отношение к диоксиду серы растительных организмов. Очень малое содержание его в воздухе (порядка 0,1 мг/м3), по-видимому, необходимо для нормального развития растений, тогда как более высокие концентрации оказываются очень вредными. Отдельные растения обладают разной чувствительностью по отношению к SO2. Так, из деревьев она наибольшая у ели и сосны, наименьшая — у берёзы и дуба. Из цветов особенно чувствительны к SO2 розы.
Помимо громадных количеств SO2, используемых для выработки серной кислоты, газ этот находит непосредственное применение в бумажном и текстильном производствах, при консервировании плодов и ягод, для предохранения вин от скисания (оптимальное содержание SO2 около 20 мг/л), дезинфекции помещений и т. д. Получают его для всех этих целей чаще всего сжиганием серы. Последняя загорается на воздухе около 300 °С.
Дезинфекция жилищ сернистым газом практиковалась ещё очень давно. Любопытно даваемое этому объяснение, которое приводит в своей книге Плиний: “Сера применяется для очищения жилищ, так как многие держатся мнения, что запах и горение серы могут предохранить от всяких чародейств и прогнать всякую нечистую силу”.
Давление диоксида серы над её водным раствором очень значительно, и содержание в нём недиссоциированных молекул H2SO3, по-видимому, невелико (для отношения [H2SO3]/[SO2] даётся значение 5·10-2). Путём охлаждения концентрированного раствора может быть выделен кристаллогидрат SO2·7H2O (т. пл. 12 °С), имеющий характер аддукта. При нагревании SO2 с водой до 150 °С в запаянной трубке происходит дисмутация по схеме:
3 SO2 + 2 H2O = 2 H2SO4 + S
Сернистая кислота характеризуется константами диссоциации К1 = 2·10-2 и К2 = 6·10-8. Для неё считают возможным существование двух структур:
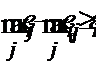 и
и  .
.
Какова структура самой кислоты, пока не ясно. Большинству её солей отвечает, по-видимому, первая из них, солям некоторых малоактивных металлов — вторая. Последняя вероятна также для кислых солей. Органические производные известны для обеих форм сернистой кислоты. Ион SO32- имеет структуру треугольной пирамиды с атомом S в вершине [d(SO) = 153 пм, ÐOSO = 105°].
Соли H2SO3 обычно получают взаимодействием SO2 с гидроксидами или карбонатами металлов в водной среде. Наибольшее практическое значение из них имеет известный только в растворе бисульфит кальция Ca(HSO3)2, который под названием “сульфитного щёлока” потребляется целлюлозной промышленностью для извлечения из древесины лигнина.
При кристаллизации раствора бисульфита натрия происходит отщепление воды по схеме:
2 NaHSO3 = H2O + Na2S2O5
с образованием натриевой соли неизвестной в свободном состоянии пиросернистой кислоты H2S2O5. Удобнее получать пиросульфит натрия сухим путём по реакции:
2 SO2 + 2 NaHCO3 = Na2S2O5 + 2 CO2 + H2O
Разложение его начинается уже при 100 °С и идёт в основном по схеме:
Na2S2O5 = Na2SO3 + SO2
Пиросульфит натрия находит применение в качестве консерванта влажного зерна и винограда. Аналогичная соль калия K2S2O5 может быть получена в виде твёрдых, бесцветных и лишь медленно растворяющихся в воде кристаллов путём насыщения сернистым газом раствора KHSO3. Под названием “метабисульфита” калия она применяется в фотографии и при крашении тканей. В её водных растворах имеет место равновесие
S2O52– + H2O Û 2 HSO3–
c приблизительно равной концентрацией обоих ионов. Для калия, рубидия и цезия в твердом состоянии были получены не только пиросульфиты, но и бисульфиты.
При прокаливании сульфиты наиболее активных металлов разлагаются при температуре около 600 °С с образованием соответствующих солей серной и сероводородной кислот, например:
4 К2SO3 = 3 К2SO4 + К2S
Процесс этот аналогичен образованию перхлоратов и хлоридов при накаливании хлоратов.
Из процессов, не сопровождающихся изменением валентности серы практическое значение имеют реакции присоединения SO2, Н2SО3 и ее солей к некоторым органическим веществам. В частности, это относится ко многим красителям, причем образующиеся продукты присоединения большей частью либо бесцветны, либо слабоокрашены. На этом основано применение SО2 (обычно в растворе) для беления шерсти, шелка, соломы и т. п., т. е. таких материалов, которые не выдерживают отбелки при помощи сильных окислителей.
Смотрите также
Графический метод решения химических задач
Решение расчетных
задач – важнейшая составная часть школьного предмета «химия», так как это один
из приёмов обучения, посредством которого обеспечивается более глубокое и
полное усвоение уч ...
Характеристика исходного сырья
Добываемая из скважин эмульсия
представляет собой многофазную систему, состоящую из нефти, пластовой воды и
попутных нефтяных газов. Нефть представляет собой химически сложную компонентную
смесь, ...
